题目内容
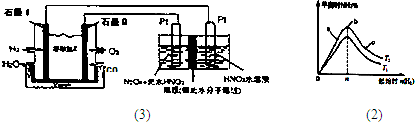
 有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )
有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )分析:根据题给信息知,该装置是将化学能转化为电能的原电池,由氢离子移动方向知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极沿方向流向正极,据此分析解答.
解答:解:根据题给信息知,该装置是将化学能转化为电能的原电池,由氢离子移动方向知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极沿方向流向正极,
A.装置外电路中箭头的方向代表电子的方向,故A错误;
B.该装置能自发的进行氧化还原反应,属于原电池,N为正极,故B错误;
C.该装置没有外接电源,所以不属于电解池,故C错误;
D.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O-24e-═6CO2↑+24H+,故D正确;
故选D.
A.装置外电路中箭头的方向代表电子的方向,故A错误;
B.该装置能自发的进行氧化还原反应,属于原电池,N为正极,故B错误;
C.该装置没有外接电源,所以不属于电解池,故C错误;
D.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O-24e-═6CO2↑+24H+,故D正确;
故选D.
点评:本题考查了原电池原理,明确原电池正负极上得失电子、电子流向、电解质溶液中阴阳离子移动方向即可解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
硅被誉为无机非金属材料的主角.据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”“未来的石油”.下列有关说法正确的是( )
| A、我国神九三位宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | B、硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 | C、存放NaOH溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | D、硅是一种良好的半导体材料,所以是制造光导纤维的基本原料 |
据报道,用10B合成的10B20有较好的抗癌作用.下列叙述正确的是( )
| A、10B20是一种新型化合物 | B、10B的中子数和核外电子数相等 | C、10B20晶体熔点高,硬度大 | D、10B和10B20互为同位素 |