题目内容
12.下列说法正确的是( )| A. | 可以用酒精萃取碘水中的碘单质 | |
| B. | 配制硫酸铁溶液时向其中加入少量稀硫酸 | |
| C. | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含SO42- | |
| D. | 可用pH试纸测定新制氯水的pH |
分析 A.酒精与水互溶,不能作萃取剂;
B.铁离子水解,配制溶液应抑制水解,且不能引入新杂质;
C.白色沉淀为硫酸钡或AgCl;
D.氯水中HClO具有漂白性.
解答 解:A.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳萃取碘水中的碘单质,故A错误;
B.铁离子水解,配制溶液应抑制水解,且不能引入新杂质,则配制硫酸铁溶液时向其中加入少量稀硫酸,故B正确;
C.白色沉淀为硫酸钡或AgCl,则溶液中可能含SO42-或银离子,但二者不能同时存在,故C错误;
D.氯水中HClO具有漂白性,不能利用pH试纸测定其pH,应选pH计来测定,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、溶液配制、离子检验、pH测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
2.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| B. | 使甲基橙显红色溶液中:K+、Na+、Cu2+、SO42- | |
| C. | 常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入铝粉放出大量氢气的溶液:Fe2+、Na+、Cl-、NO3- |
3.下列各组混合物属铝热剂的是( )
| A. | AlCr2O3 | B. | Al2O3Fe | C. | AlMgO | D. | AlCO2 |
20.合成抗哮喘及抗过敏药普仑司特的某种中间体结构如图:

有关该中间体的说法正确的是( )

有关该中间体的说法正确的是( )
| A. | 该分子中含有1个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1mol该化合物与足量NaOH溶液反应,最多消耗4molNaOH | |
| D. | 1mol该化合物与足量浓溴水反应,最多消耗1molBr2 |
7.下列物质的转化中,不能通过-步化学反应实现的是( )
| A. | Fe-Fe3O4 | B. | C2H2-CO2 | C. | CH2=CH2→CH3CH3 | D. | A12O3→Al(OH)3 |
17.下列离子方程式中,正确的是( )
| A. | 在氯化铝溶液中加入过量氨水Al3++3OH-=A1(OH)3↓ | |
| B. | 在硫酸铜溶液中加入过量氢氧化钡溶液Ba2++SO42-=BaSO4↓ | |
| C. | 在澄淸石灰水中通入过量二氧化碳OH-+CO2=HCO3- | |
| D. | 在碳酸氢钙溶液中加入过量氢氧化钠溶液Ca2++HCO3-+OH-=CaCO3↓ |
4.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、SO32-、ClO- | ||
| C. | K+、NO3-、Fe2+、H+ | D. | Mg2+、NH4+、Cl-、SO42- |
5.对于aA(g)+bB(g)?cC(g)反应,改变某一变量(条件)得到如图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率).根据图象,下列判断正确的是( )


| A. | 反应 I:若 p1>p2,则 a+b>c | |
| B. | 反应Ⅱ:此反应的△H>0,且 T1<T2 | |
| C. | 反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响 | |
| D. | 反应Ⅳ:表示t1时刻增大 B 的浓度对反应速率的影响 |
6.下列有关叙述不正确的是( )
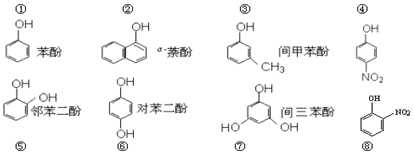
⑨HNO3 ⑩NH3.

⑨HNO3 ⑩NH3.
| A. | 能形成分子内氢键的有⑤⑧⑨ | |
| B. | 能形成分子间氢键有①②③④⑥⑦⑩ | |
| C. | 根据氢键形成的条件,可以推测还有元素Li的原子可以代替氢原子而形成类似氢键的结构 | |
| D. | C2H6O分子中同时存在极性键、非极性键和氢键 |