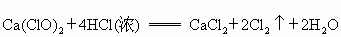题目内容
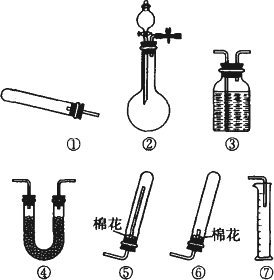
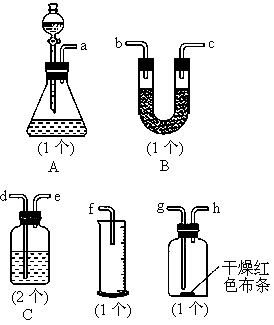
 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
(1)铜与浓硫酸反应的化学方程式是______.
(2)实验过程中,观察到品红试液______.为进一步确认产生的气体是二氧化硫气体,还应补充的操作是______.
(3)假如棉花团中预先浸入氢氧化钠浓溶液,其作用是______,该反应的离子方程式是______.
(4)为终止实验,应首先采取的实验操作是______.
解:(1)在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,故答案为:Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)硫酸的还原产物SO2具有漂泊性,能使品红溶液褪色.但SO2的漂白是不稳定的,在加热的情况下,可以恢复到用来的颜色,所以要检验二氧化硫气体,需要加热,若品红试液恢复红色,即证明是二氧化硫,故答案为:褪色;加热褪色后的品红试液;
(3)SO2是大气污染物,因此氢氧化钠浓溶液吸收多余SO2,防止污染空气,发生的反应为:SO2+2OH-=SO32-+H2O;故答案为:吸收多余的SO2;SO2+2OH-=SO32-+H2O;
(4)使铜丝和浓硫酸分离即可终止实验,所以要把铜丝从浓硫酸中抽出,故答案为:小心将铜丝从浓硫酸中抽出.
分析:(1)在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)SO2具有漂泊性,使品红溶液褪色,但SO2的漂白是不稳定的;
(3)SO2是大气污染物,因此氢氧化钠浓溶液吸收多余SO2,离子方程式:SO2+2OH-=SO32-+H2O
(4)使铜丝和浓硫酸分离即可终止实验.
点评:本题考查了浓硫酸和铜的反应,二氧化硫的性质及检验,离子方程的书写,难度中等.
 CuSO4+2H2O+SO2↑,故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,故答案为:Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;(2)硫酸的还原产物SO2具有漂泊性,能使品红溶液褪色.但SO2的漂白是不稳定的,在加热的情况下,可以恢复到用来的颜色,所以要检验二氧化硫气体,需要加热,若品红试液恢复红色,即证明是二氧化硫,故答案为:褪色;加热褪色后的品红试液;
(3)SO2是大气污染物,因此氢氧化钠浓溶液吸收多余SO2,防止污染空气,发生的反应为:SO2+2OH-=SO32-+H2O;故答案为:吸收多余的SO2;SO2+2OH-=SO32-+H2O;
(4)使铜丝和浓硫酸分离即可终止实验,所以要把铜丝从浓硫酸中抽出,故答案为:小心将铜丝从浓硫酸中抽出.
分析:(1)在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;(2)SO2具有漂泊性,使品红溶液褪色,但SO2的漂白是不稳定的;
(3)SO2是大气污染物,因此氢氧化钠浓溶液吸收多余SO2,离子方程式:SO2+2OH-=SO32-+H2O
(4)使铜丝和浓硫酸分离即可终止实验.
点评:本题考查了浓硫酸和铜的反应,二氧化硫的性质及检验,离子方程的书写,难度中等.

练习册系列答案
相关题目
某同学用如图所示的装置来制取和探究气体(H2、O2、Cl2、SO2、NO2)的性质.
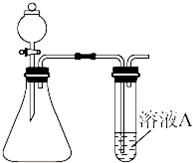 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作
(2)如果用该装置制取H2、O2,可选用的试剂组合是 (填序号).
(3)五种气体中,可同时采用如图所示两种收集装置收集的气体是 .
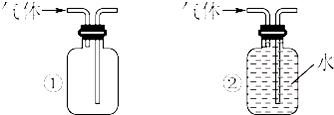
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式: .
②若溶液A为溴水,通入SO2后现象是 ;若溶液A为溴化钠溶液,通入氯气时反应的离子方程式为 .实验证明Br2、SO2和Cl2氧化性由大到小的顺序为 .
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为 .两同学还想比较Cl2和
SO2漂白的差异性,还需要的操作和可能观察到的现象为 .
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作(2)如果用该装置制取H2、O2,可选用的试剂组合是
| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
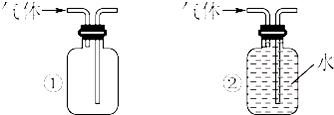
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式:
②若溶液A为溴水,通入SO2后现象是
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为
SO2漂白的差异性,还需要的操作和可能观察到的现象为