题目内容
某混合物 A,含有 KAl(SO4)2、Al2O3和 Fe2O3,在一定条件下可实现下图所示的物质之间的变化,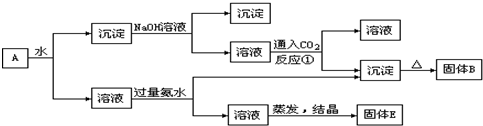
据此判断
(1)固体B所含物质的化学式为
(2)固体E所含物质的化学式为
(3)反应①的离子方程式为
分析:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4;
向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量).
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4;
向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量).
解答:解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量),Al(OH)3受热分解:2Al(OH)3
Al2O3+3H2O,生成Al2O3,所以固体B是Al2O3;
(1)分析推断可知,流程中的固体B为氧化铝,
故答案为:Al2O3;
(2)依据流程图分析可知,溶于水后的溶液为硫酸铝钾溶液,加入过量氨水生成硫酸铵;硫酸钾和氢氧化铝沉淀,过滤得到滤液为硫酸钾和硫酸铵的水溶液,蒸发结晶得到固体E所含物质的化学式为K2SO4 和(NH4)2SO4,
故答案为:K2SO4 和(NH4)2SO4;
(3)反应①向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和Na2CO3(或者NaHCO3,取决于CO2的量),
反应①CO2不足时,生成Al(OH)3沉淀和碳酸钠,离子方程式为:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓;
CO2过量时,生成Al(OH)3沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓,
故答案为:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓或AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓.
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和碳酸钠(或者碳酸氢钠,取决于CO2的量),Al(OH)3受热分解:2Al(OH)3
| ||
(1)分析推断可知,流程中的固体B为氧化铝,
故答案为:Al2O3;
(2)依据流程图分析可知,溶于水后的溶液为硫酸铝钾溶液,加入过量氨水生成硫酸铵;硫酸钾和氢氧化铝沉淀,过滤得到滤液为硫酸钾和硫酸铵的水溶液,蒸发结晶得到固体E所含物质的化学式为K2SO4 和(NH4)2SO4,
故答案为:K2SO4 和(NH4)2SO4;
(3)反应①向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和Na2CO3(或者NaHCO3,取决于CO2的量),
反应①CO2不足时,生成Al(OH)3沉淀和碳酸钠,离子方程式为:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓;
CO2过量时,生成Al(OH)3沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓,
故答案为:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓或AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓.
点评:本题以框图形式考查物质的性质,具有一定的综合性,主要考查铝及其化合物性质的应用,本题的关键在于Al2O3具有两性,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



