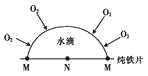
��Ŀ����
����Ŀ��ijͬѧ�������ʵ�鷽��,�Է���KCl��BaCl2���ֹ�������,�Իش��������⣺
��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ�����ᡣ
(1)�����ٵ�������_________��
(2)�Լ�a��_________,�Լ�b ��_________ ��
(3)�����Լ�a��������Ӧ�����ӷ���ʽΪ_________�������Լ�b��������Ӧ�����ӷ���ʽΪ_________��
(4)�÷����ܷ�ﵽʵ��Ŀ��:_____(��ܡ����ܡ�)��������,Ӧ��θĽ�? _____������,���ʲ��ûش�)��
(5)��Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⡣���ٻ�Ҫ��õ�������_________��������
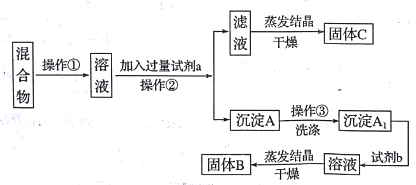
���𰸡��ܽ� K2CO3��Һ ���� CO32-+Ba2+=BaCO3�� BaCO3+2H+=Ba2++CO2��+H2O ���� Ӧ�ڲ����ڵ���Һ�м������������������ᾧ ����A1(�����B)
��������
�����̿�֪������KCl��BaCl2���ֹ��������������ˮ��Ȼ�����aΪ����K2CO3ʹBaCl2ת��Ϊ���������˺����AΪ̼�ᱵ�������Լ�bΪ���������BaCl2��Һ�����������ᾧ�������ɵù���BaCl2��������������ҺΪKCl��K2CO3�Ļ���Ӧ�����������ɵ�KCl�����ݴ˷������н��
��1�������������Һ��Ӧ��ˮ�ܽ⡣
��2��aΪ����K2CO3ʹBaCl2ת��Ϊ���������˺����AΪ̼�ᱵ�������Լ�bΪ���������BaCl2��Һ��
��3�������Լ�a��K2CO3��BaCl2��Ӧ����BaCO3��������ӦΪK2CO3+BaCl2��BaCO3��+2KCl�����������ӷ���ʽΪCO32-+Ba2+=BaCO3���������Լ�b��̼�ᱵ��HCl��������Ӧ�����ӷ���ʽΪBaCO3+2H+=Ba2++CO2��+H2O��
��4��������������֪����ʵ�鲻�ܴﵽĿ�ģ�������ڵ���Һ�л���̼��أ�Ӧ�ӹ�������������ᾧ��
��5����Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⣬���ٻ�Ҫ��õ������ǹ���B�����������A1����������������������֮һ���������ܼ����BaCl2���������Ӷ����������������

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д�����Ŀ���о���Ԫ�ؼ��仯��������ʾ�����Ҫ���塣
(1)25 �棬��0.10 mol��L��1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��[S2��]��ϵ����ͼ(������Һ����ı仯��H2S�Ļӷ�)��
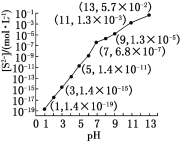
��pH��13ʱ����Һ�е�[H2S]��[HS��]��__________mol��L��1��
��ij��Һ��0.020 mol��L��1Mn2����0.10 mol��L��1H2S������ҺpH��____________ʱ��Mn2����ʼ����[��֪��Ksp(MnS)��2.8��10��13]��
(2)25 �棬������ĵ���ƽ�ⳣ�����±���
���� | Ka1 | Ka2 |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
��HSO�ĵ���ƽ�ⳣ������ʽK��________��
��0.10 mol��L��1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ____________________��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ_________________________��
����Ŀ��ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+�����ֺ�̽���������¡�
�������ữ��0.05 mol��L-1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ�_______�������������֤����ɫ�����к���Ag��
��ȡ�ϲ���Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵����Һ�к���_______________��
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ����Fe3+������Ϊ���۹���ʱ��������Fe3+�������ݵ�ԭ����___________________�������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⡣ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3 minʱ���٣���Һ��ɫ��3 minʱ���� |
�� | 120 | ������ɫ��������30 minʱ���٣���Һ��ɫ��30 minʱ��dz |
�����ϣ�Ag+��SCN-���ɰ�ɫ����AgSCN��
�� ��Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2������________�������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3-���������ԣ��ɲ���Fe3+��
����d������_______�����ж���Һ�д���Ag+���ɲ���Fe3+��
�� ����ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ��________��Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3 minʱ��Һ��dz��ɫ��30 min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ��________��������������________________��
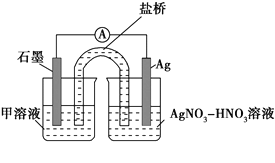
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡~����Fe3+Ũ�ȱ仯��ԭ��______��