题目内容
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)恒温下,往一个2 L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
5 min内,消耗N2的平均反应速率为________,此条件下该反应的化学平衡常数K=________;
(2)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
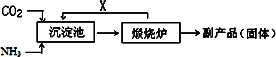
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是________.
②煅烧炉中产生的固态副产品为________,生产流程中能被循环利用的物质X为________.
(3)将SO2通入BaCl2溶液中无明显现象,当通入足量氨气时,则有白色沉淀生成,写出对应的化学方程式________
(4)将浓氨水滴到生石灰上,能快速制得氨气,制取氨气的反应原理为(写出必要的文字说明和化学方程式)________
解析:
答案:(1)0.008 mol·L-1·min-1 0.1[或0.1(mol·L-1)-2]
(2)①氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,
增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4
②CaO(或生石灰) CO2(或二氧化碳)
(3)2NH3+SO2+H2O=(NH4)2SO3、(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl
(4)其反应原理为:一是CaO溶于水中,放出大量的热,促进了氨水的分解,二是提供的大量的OH-,使平衡朝着生成NH3的方向移动.涉及的化学方程式为CaO+H2O=Ca(OH)2、NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
解析:(1)V(NH3)=0.08 mol·L-1/5 min,V(N2)=1/2×0.08 mol·L-1/5 min=0.008 mol·L-1·min-1.可通过计算20 min时平衡体系各物质的量浓度为c(NH3)=0.20 mol·L-1、c(N2)=0.40 mol·L-1,c(H2)=1.0 mol·L-1,利用平衡常数公式K=c(NH3)2/c(N2).c(H2)3=0.1
(3)足量NH3与SO2及H2O反应生成亚硫酸铵,亚硫酸铵再与BaCl2溶液反应生成白色沉淀BaSO3.
(4)其反应原理为:一是CaO溶解于水中,和水反应放出大量的热,促进了氨水的分解,有利于氨气放出;二是CaO与水反应生成了Ca(OH)2提供的大量的OH-,使平衡朝着生成NH3的方向移动.涉及的化学方程式:CaO+H2O=Ca(OH)2、NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案


