题目内容
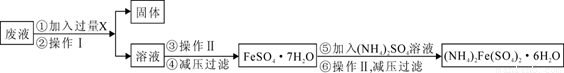
 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
①试配平反应的离子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O
②滴定时,将KMnO4溶液装在______(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为______.
③产品中摩尔盐的质量分数______.
解:(2)由装置图可知,向容器①中通入氢气,应关闭活塞A,打开活塞B、C.硫酸铵溶液中的溶解O2,容器①液面上部有O2,Fe2+易被氧化为Fe3+,通入氢气赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+;
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+;
(4)①高锰酸钾与Fe2+的反应是MnO4-~Mn2+~5e-;Fe2+~Fe3+~e-;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;故答案为:1 5 8 1 5 4;
②高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
故答案为:酸式; 当溶液变成紫红色且30s内不褪色;
③假设24.50g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1000mol/L×10
所以x= =0.05mol.
=0.05mol.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的为0.05mol,
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量为0.05mol×392g/mol=19.6g.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量分数为 ×100%=80%.
×100%=80%.
故答案为:80%.
分析:(2)由装置图可知,容器②的长导管插入液面以下,氢气只能从容器②的短导管出来,经过容器③加向容器①中.通入氢气排尽装置内空气,防止Fe2+氧化;
(4)①依据氧化还原反应电子守恒、电荷收、原子守恒配平写出离子方程式:
②高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
③根据关系式5Fe2+~MnO4-计算24.50g产品中Fe2+的物质的量,由(NH4)2SO4?FeSO4?6H2O可知Fe2+的物质的量等于莫尔盐的物质的量,再根据m=nM计算莫尔盐的质量,利用质量分数定义计算.
点评:本题以莫尔盐的制备为载体,考查物质分离提纯等有关实验操作、实验原理与装置的理解分析与评价、对催化能力的探究实验的理解、氧化还原反应滴定应用以计算、以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,容易忽略所取溶液体积,为易错点.
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+;
(4)①高锰酸钾与Fe2+的反应是MnO4-~Mn2+~5e-;Fe2+~Fe3+~e-;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;故答案为:1 5 8 1 5 4;
②高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
故答案为:酸式; 当溶液变成紫红色且30s内不褪色;
③假设24.50g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1000mol/L×10
所以x=
 =0.05mol.
=0.05mol.所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的为0.05mol,
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量为0.05mol×392g/mol=19.6g.
所以24.50g产品中(NH4)2SO4?FeSO4?6H2O的质量分数为
 ×100%=80%.
×100%=80%.故答案为:80%.
分析:(2)由装置图可知,容器②的长导管插入液面以下,氢气只能从容器②的短导管出来,经过容器③加向容器①中.通入氢气排尽装置内空气,防止Fe2+氧化;
(4)①依据氧化还原反应电子守恒、电荷收、原子守恒配平写出离子方程式:
②高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
③根据关系式5Fe2+~MnO4-计算24.50g产品中Fe2+的物质的量,由(NH4)2SO4?FeSO4?6H2O可知Fe2+的物质的量等于莫尔盐的物质的量,再根据m=nM计算莫尔盐的质量,利用质量分数定义计算.
点评:本题以莫尔盐的制备为载体,考查物质分离提纯等有关实验操作、实验原理与装置的理解分析与评价、对催化能力的探究实验的理解、氧化还原反应滴定应用以计算、以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,容易忽略所取溶液体积,为易错点.

练习册系列答案
相关题目