题目内容
在密闭容器中进行如下反应:H2(g)+I2(g)
A.T1>T2,![]() >0 B.T1>T2,
>0 B.T1>T2,![]() <0
<0
C. T1<T2,![]() >0 D. T1<T2,
>0 D. T1<T2,![]() <0
<0
D
解析:据“先拐先平衡”,由图象知T2>T1,温度升高碘化氢的量减小,即平衡向逆反应方向移动,所以正反应为放热反应,即ΔH<0,D正确。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
在密闭容器中进行如下反应:X(g)+Y(g)?2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,达到平衡时,各物质的浓度不可能是( )
| A、Z为0.3 mol/L | B、Y为0.15 mol/L | C、X为0.1 mol/L | D、Z为0.4 mol/L |
在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )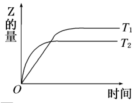

| A、T1<T2,正反应是放热反应 | B、T1<T2,正反应是吸热反应 | C、T1>T2,正反应是放热反应 | D、T1>T2,正反应是吸热反应 |
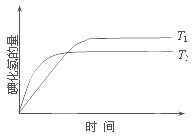 在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )