题目内容
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是___________________。
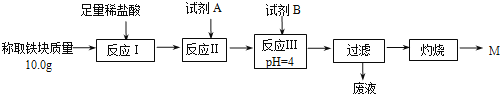
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
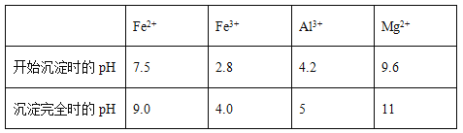
① 试剂A应选择________,试剂B应选择_______(填序号)。
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式____________________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4__________。

④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是_______。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
【答案】引发铝热反应 C D 2Fe2++ H2O2+2H+=2Fe3++2H2O 足量稀硫酸;几滴(少量)高锰酸钾溶液;溶液紫红色未褪去 连续两次灼烧质量相差不大于0.1 g 84.0%
【解析】
(1)根据铝热反应需要高温条件分析解答。
(2)取反应后的“铁块”溶于盐酸,生成铁盐或亚铁盐、镁离子和铝离子,根据离子的性质结合流程图分析解答。
(1)使用镁条和氯酸钾的目的是点燃镁条燃烧放热促进氯酸钾分解生成氯化钾和氧气,起到高温引发铝热反应的目的,即使用镁条和氯酸钾的目的是引发铝热反应。
(2)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需要将亚铁离子转化为铁离子,又因为不能引入新杂质,所以需要加入双氧水,然后调节4≤pH<4.2即可将铁离子沉淀而铝离子和镁离子不沉淀。调节pH时不能用氧化铁,因为会引入铁元素,因此试剂A应选择双氧水,试剂B应选择氨水,答案选C和D。
②反应Ⅱ是双氧水氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
③氧化铁溶于酸生成铁离子,四氧化三铁溶于酸生成铁离子和亚铁离子,因此要设计简单实验证明M的成分是Fe2O3而非Fe3O4只需要证明溶液中含有亚铁离子即可,所以实验方案为取少量M固体于试管中,向其中加入足量稀硫酸,固体完全溶解,溶液呈棕黄色,继续向上层溶液中滴加几滴少量高锰酸钾溶液,振荡观察紫红色溶液未褪去,说明不含有亚铁离子。
④上述实验应灼烧至M质量不变,则能证明M质量不变的标志是连续两次灼烧质量相差不大于0.1 g。
⑤若最终红色粉未M的质量为12.0 g,即氧化铁是12.0g,物质的量是12.0g÷160g/mol=0.075mol,所以铁元素的质量是0.075mol×2×56g/mol=8.4g,则该“铁块”的纯度是8.4g/10g×100%=84.0%。

【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列问题。
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | (11) | ⑧ | ⑩ | ||||
三 | ① | ③ | ⑤ | ⑦ | (12) | ⑨ | ||
四 | ② | ④ |
(1)在这12种元素中,化学性质最不活泼的元素名称是______,得电子能力最强的原子是_____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是_____(写化学式)。
(2)
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ______。
(4)请写出:
(ⅰ) ③的单质置换出⑥的单质的化学方程式:_________________________。
(ⅱ) ⑤和(11)两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________。
(ⅲ)元素⑨的单质和元素①的最高价氧化物对应的水化物常温下反应的化学方程式为__。