题目内容
Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
⑴ 甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是 ;
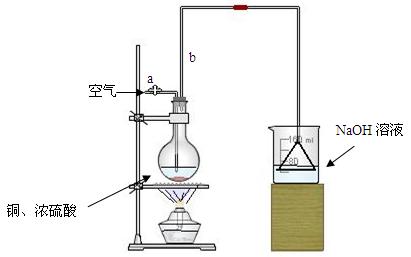
⑵ 乙同学为验证Fe能和热的浓HNO3反应,设计了如下图所示的实验装置,请你指出装置中的不足之处 ; ;
。

⑶ 丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。
丙同学依据反应现象得出Cu片溶解的原因可能是和HNO3发生反应。他依据的反应现象是 ;请写出Cu片和稀HNO3反应的离子方程式
你认为Cu片溶解的不同于丙同学的理由是
⑷ 请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象
。
⑴ 甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是 ;
⑵ 乙同学为验证Fe能和热的浓HNO3反应,设计了如下图所示的实验装置,请你指出装置中的不足之处 ; ;
。

⑶ 丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。
丙同学依据反应现象得出Cu片溶解的原因可能是和HNO3发生反应。他依据的反应现象是 ;请写出Cu片和稀HNO3反应的离子方程式
你认为Cu片溶解的不同于丙同学的理由是
⑷ 请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象
。
(1)Cu在Cl2中燃烧,产生棕色烟(1分)
(2)试管中的液体超过试管容积的三分之一(1分);加热液体的试管应与桌面成45°角向上倾斜而不应垂直向上(1分);尾气吸收装置容易发生倒吸(1分)
(3)①试管上部出现红棕色气体或无色气体(1分) ②3Cu+2NO3-+8 H+=3Cu 2++2NO+4 H2O (2分),反应产生的Fe3+也能和Cu反应而使Cu片溶解(2分)
(4)取该溶液少许,滴加适量的KSCN溶液,不出现血红色,再滴加适量新制氯水,出现血红色(2分)
(2)试管中的液体超过试管容积的三分之一(1分);加热液体的试管应与桌面成45°角向上倾斜而不应垂直向上(1分);尾气吸收装置容易发生倒吸(1分)
(3)①试管上部出现红棕色气体或无色气体(1分) ②3Cu+2NO3-+8 H+=3Cu 2++2NO+4 H2O (2分),反应产生的Fe3+也能和Cu反应而使Cu片溶解(2分)
(4)取该溶液少许,滴加适量的KSCN溶液,不出现血红色,再滴加适量新制氯水,出现血红色(2分)
略

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目

 1 mol·L-1BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
1 mol·L-1BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
 越大。
越大。
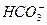 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7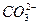 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11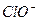 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8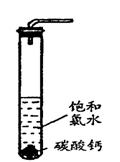
 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。





