题目内容
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
【答案】C
【解析】
A.甲醛分子中与H形成共价键的C原子的电负性没有那么大,与其相连的H原子不会成为“裸露”质子,甲醛分子间不存在氢键,A项错误;
B.甲醛中C原子形成3个σ键和1个π键,C上没有孤电子对,其中C为sp2杂化,甲醇分子中C原子形成4个σ键,C上没有孤电子对,其中C为sp3杂化,B项错误;
C.甲醛分子为平面三角形,分子中正负电中心不重合,是极性分子,C项正确;
D.甲醇分子中有—OH,可以形成分子间氢键,甲醇的沸点比甲醛的沸点高,D项错误;
本题答案选C。

【题目】向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是( )
操作 | 现象 | 结论 | |
A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象白色沉淀 | 原溶液一定含SO |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO |
C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象白色沉淀 | 原溶液一定含Cl- |
D | ①加KSCN溶液 ②滴加氯水 | 无明显现象溶液呈红色 | 原溶液一定含Fe2+ |
A.AB.BC.CD.D
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
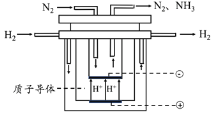
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。