题目内容
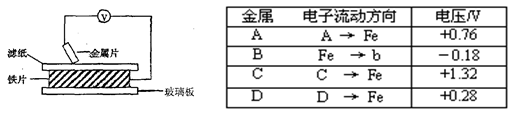
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:金属 | 电子流动方向 | 电压/V |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
C | C→Cu | +1.35 |
D | D→Cu | +0.30 |

已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请依据表中的数据判断:
(1)______________金属可以是最强的还原剂;____________金属一定不能从硫酸铜溶液中置换出铜。
(2)在滤纸上能看到有蓝色沉淀析出的是______________(填字母)金属。其对应的原电池的电极反应式为负极:______________,正极:______________。
(1)C B
(2)B 负极:2Cu+4OH--4e-![]() 2Cu(OH)2↓ 正极:2H2O+O2+4e-
2Cu(OH)2↓ 正极:2H2O+O2+4e-![]() 4OH-
4OH-
解析:(1)因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子流动的方向,各种金属的活泼性顺序为C>A>D>Cu>B。
(2)若用NaOH溶液作电解质,在滤纸上能看到蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
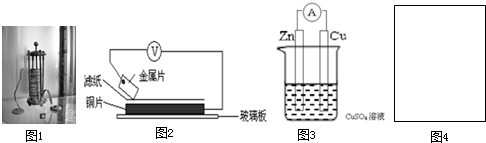
 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下: 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下: