题目内容
下列说法不正确的是( )
| A、化学键的断裂不一定引起化学反应 |
| B、金属阳离子还原不一定得到相应的金属单质 |
| C、根据分散质粒子直径的大小可以将分散系分为溶液,胶体和浊液 |
| D、如果某化学反应的△H和△S均大于0,则该反应肯定不能自发进行 |
考点:反应热和焓变,分散系、胶体与溶液的概念及关系
专题:基本概念与基本理论
分析:A、化学键的断裂不一定引起化学反应;
B、金属阳离子还原过程对应元素的化合价降低;
C、溶液,胶体和浊液的本质区别是:分散质粒子直径的大小;
D、根据反应是否能自发进行的判据:△H-T△S<0来回答.
B、金属阳离子还原过程对应元素的化合价降低;
C、溶液,胶体和浊液的本质区别是:分散质粒子直径的大小;
D、根据反应是否能自发进行的判据:△H-T△S<0来回答.
解答:
解:A、化学键的断裂不一定引起化学反应,如氯化氢溶于水得到盐酸的过程,故A正确;
B、金属阳离子还原过程对应元素的化合价降低,不一定得到相应的金属单质,如铁离子被还原为亚铁离子的过程,故B正确;
C、根据分散质粒子直径的大小可以将分散系分为溶液,胶体和浊液,故C正确;
D、反应是否能自发进行的判据:△H-T△S<0,一定自发,如果某化学反应的△H和△S均大于0,则在高温下能自发进行,故D错误.
故选D.
B、金属阳离子还原过程对应元素的化合价降低,不一定得到相应的金属单质,如铁离子被还原为亚铁离子的过程,故B正确;
C、根据分散质粒子直径的大小可以将分散系分为溶液,胶体和浊液,故C正确;
D、反应是否能自发进行的判据:△H-T△S<0,一定自发,如果某化学反应的△H和△S均大于0,则在高温下能自发进行,故D错误.
故选D.
点评:本题是关于基本概念和基本理论的理解和掌握的考查题,考查学生对知识的掌握和应用能力,难度不大.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、加入苯酚显紫色的溶液;K+、NH+4、Cl-、I- |
| B、pH=12的溶液:Na+、Ca2+、HCO-3、Cl- |
| C、水电离出的c(H+)=10-12mo1?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、0.1 mol?L-1的Cu(NO3)2溶液:Na+、K+、S2-、SO2-4- |
某温度下,将Cl2通入NaOH溶液,得到NaCl、NaClO、NaClO3的混合液,经测定ClO-、ClO3-的浓度之比为5:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A、21:5 | B、11:3 |
| C、5:2 | D、4:1 |
下列描述,其因果关系成立的是( )
| A、因为NH3的水溶液可以导电,所以NH3是电解质 |
| B、因为SO2可以使溴水褪色,所以SO2具有漂白性 |
| C、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D、因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应 |
反应2SO2+O2
2SO3经过一段时间后,SO3的浓度增加了0.4mol?L-1,在这段时间内用O2表示的反应速率为0.04mol?(L?s)-1,则这段时间为( )
| ||
| △ |
| A、0.1 s |
| B、2.5 s |
| C、5 s |
| D、10 s |
已知A、B、C、D均是气体,反应A+B?C+D的能量变化如图所示,下列说法正确的是( )
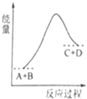

| A、当A的正反应速率与C的逆反应速率相同时处于平衡状态 |
| B、当A、B、C、D的浓度相同时,反应处于平衡状态 |
| C、反应物的总键能量低于生成物的总键能 |
| D、该反应是放热反应 |
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
| A、H2XO3 |
| B、HXO3 |
| C、H3XO4 |
| D、H2XO4 |
天然气和液化石油气(主要成分为C3~C8的烷烃)燃烧的化学方程式分别是:CH4+2O2
CO2+2H2O,C3H8+5O2
3CO2+4H2O.现有一套以天然气为燃料的灶具,欲改烧液化石油气,应采用的正确措施是( )
| 点燃 |
| 点燃 |
| A、减小空气进入量,减小石油气进入量 |
| B、增大空气进入量或减小石油气进入量 |
| C、增大空气进入量,增大石油气进入量 |
| D、减小空气进入量或增大石油气进入量 |
下列做法中不符合“绿色化学”思想的是( )
| A、以水性涂料代替油性涂料 |
| B、以无磷洗涤剂代替含磷洗涤剂 |
| C、实验后的有毒有害物质应分类收集、统一处理 |
| D、在通风橱中制氯气时不用NaOH溶液吸收尾气 |