题目内容
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得澄清溶液,现取3份 100mL该溶液分别进行如下实验:
已知加热时NH4++OH-═NH3↑+H2O,试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是 .
(2)试确定溶液中一定存在的阴离子及其物质的量浓度: .
(3)试确定K+是否存在? (填“存在”或“不存在”),判断的理由是 .
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则据此计算的c(SO42-) ,
c(CO32-) ,c(K+) .(均选填“偏大”、“偏小”或“无影响”,假设溶液中只有四种离子)
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体1.12L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
(1)根据实验1对Cl-是否存在的判断是
(2)试确定溶液中一定存在的阴离子及其物质的量浓度:
(3)试确定K+是否存在?
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则据此计算的c(SO42-)
c(CO32-)
考点:常见离子的检验方法,离子共存问题
专题:实验题
分析:(1)因碳酸银、硫酸银、氯化银都是白色沉淀,因此实验1对确定是否含有氯离子不能确定;利用实验2可知含有铵离子,利用实验3可知沉淀一定是碳酸钡和硫酸钡,即溶液中一定含有CO32-、SO42-,则溶液中一定不含Ba2+、Mg2+;
(2)碳酸钡可溶于盐酸,硫酸钡不溶于盐酸,因此加入盐酸后剩余2.33g固体为BaSO4,利用硫、碳守恒即可求算出溶液中c(SO42-)、(CO32-)的物质的量浓度;
(3)结合前面和题中数据可知,溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒得K+一定存在;
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则最后得到沉淀质量偏大,使测得c(SO42-)偏大、因最后沉淀质量偏大,则质量差小,导致碳酸钡质量减小,使测得c(CO32-)偏小、又因总质量一定,若硫酸根离子偏大导致阴离子总物质的量偏小,则导致c(K+)偏小.
(2)碳酸钡可溶于盐酸,硫酸钡不溶于盐酸,因此加入盐酸后剩余2.33g固体为BaSO4,利用硫、碳守恒即可求算出溶液中c(SO42-)、(CO32-)的物质的量浓度;
(3)结合前面和题中数据可知,溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒得K+一定存在;
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则最后得到沉淀质量偏大,使测得c(SO42-)偏大、因最后沉淀质量偏大,则质量差小,导致碳酸钡质量减小,使测得c(CO32-)偏小、又因总质量一定,若硫酸根离子偏大导致阴离子总物质的量偏小,则导致c(K+)偏小.
解答:
(1)碳酸银、硫酸银、氯化银都是白色沉淀,因此实验1得到沉淀无法确定是氯化银,故实验1对Cl-是否存在的判断是:不能确定;利用实验2可知含有铵离子,利用实验3可知沉淀一定是碳酸钡和硫酸钡,即溶液中一定含有CO32-、SO42-,碳酸钡、碳酸镁、硫酸钡等都是不溶于水的沉淀,故可判知溶液一定不存在的离子是:Ba2+、Mg2+,故答案为:不能确定;Ba2+、Mg2+;
(2)结合(1)中分析可知溶液中一定含有的阴离子为CO32-、SO42-,由碳酸钡可溶于盐酸,硫酸钡不溶于盐酸可推知加入盐酸后剩余2.33g固体为BaSO4,利用硫守恒可知溶液中c(SO42-)=2.33g233g/mol÷0.1L=0.1mol/L;6.27g固体中碳酸钡的质量为6.27g-2.33g=3.94g,利用碳守恒可知溶液中c(CO32-)=3.94g197g/mol÷0.1L=0.2mol/L,故答案为:SO42-0.1mol/L、CO32- 0.2mol/L;
(3)溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为1.12L22.4L/mol=0.05 mol,利用(2)中分析、计算可知CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒可知溶液中一定存在K+,
故答案为:存在,溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒得K+一定存在;
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则最后得到沉淀质量偏大,使测得c(SO42-)偏大、因最后沉淀质量偏大,则质量差小,导致碳酸钡质量减小,使测得c(CO32-)偏小、总质量一定,硫酸根离子偏大导致阴离子总物质的量偏小,则导致c(K+)偏小,故答案为:偏大;偏小;偏小.
(2)结合(1)中分析可知溶液中一定含有的阴离子为CO32-、SO42-,由碳酸钡可溶于盐酸,硫酸钡不溶于盐酸可推知加入盐酸后剩余2.33g固体为BaSO4,利用硫守恒可知溶液中c(SO42-)=2.33g233g/mol÷0.1L=0.1mol/L;6.27g固体中碳酸钡的质量为6.27g-2.33g=3.94g,利用碳守恒可知溶液中c(CO32-)=3.94g197g/mol÷0.1L=0.2mol/L,故答案为:SO42-0.1mol/L、CO32- 0.2mol/L;
(3)溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为1.12L22.4L/mol=0.05 mol,利用(2)中分析、计算可知CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒可知溶液中一定存在K+,
故答案为:存在,溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒得K+一定存在;
(4)若实验3中沉淀加稀盐酸后未洗涤干燥,则最后得到沉淀质量偏大,使测得c(SO42-)偏大、因最后沉淀质量偏大,则质量差小,导致碳酸钡质量减小,使测得c(CO32-)偏小、总质量一定,硫酸根离子偏大导致阴离子总物质的量偏小,则导致c(K+)偏小,故答案为:偏大;偏小;偏小.
点评:本题考查离子检验,解答时需结合定量计算,思维容量大,方法灵活,值得研究该类试题的解法与命题意境.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
结构为 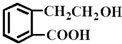 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①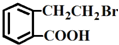 ②
②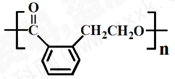 ③
③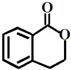 ④
④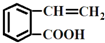
生成这四种有机物的反应类型依次为( )
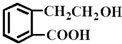 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:①
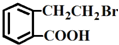 ②
② ③
③ ④
④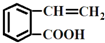
生成这四种有机物的反应类型依次为( )
| A、酯化、取代、缩聚、取代 |
| B、取代、取代、加聚、消去 |
| C、取代、缩聚、酯化、消去 |
| D、取代、加成、酯化、消去 |
以下说法正确的是( )
| A、物质所含元素化合价升高的反应叫还原反应 |
| B、还原剂中必定有一种元素被氧化 |
| C、物质中某元素失去电子,则此物质是氧化剂 |
| D、在氧化还原反应中,失去电子的元素化合价降低 |
 高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:
高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:
 i.
i. j.
j. k.
k.