题目内容
7.下列元素的单质的氧化性最强的是( )| A. | F | B. | Cl | C. | Br | D. | I |
分析 根据元素周期律判断,同一周期中,元素的非金属性随着原子序数的增大而增大,同一主族中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,对应的单质的氧化性越强,以此解答.
解答 解:同一主族中,元素的非金属性随着原子序数的增大而减小;氟、氯、溴、碘是同一主族元素,氟、氯、溴、碘的非金属性随着原子序数的增大而减小,所以非金属性最强的是氟,元素的非金属性越强,对应的单质的氧化性越强.
故选A.
点评 本题以元素非金属性强弱的判断为载体考查了元素周期律,为高频考点,侧重双基的考查,难度不大,注意元素周期律的正确应用.

练习册系列答案
相关题目
17.有关如图化合物的说法不正确的是( )
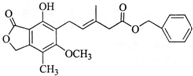

| A. | 该物质的分子式为C23H24O6 | |
| B. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
15. 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
2. 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )| A. | 每生成2molAB分子吸收b kJ热量 | |
| B. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 1molA-A键和1molB-B键的总键能高于2molA-B键的总键能 |
19.最近,复旦大学出现了校园铊投毒案,犯罪嫌疑人日前已被批捕.此前,清华大学也出现过类似的案例.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子化合物 | ||
| C. | Tl(OH)3是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
16.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2↑+NaBr+H2O |
17.下列化学用语正确的是( )
| A. | 氮分子的电子式: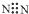 | B. | 硫原子的结构示意图: | ||
| C. | CO2的电子式: | D. | 水分子的结构式: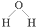 |
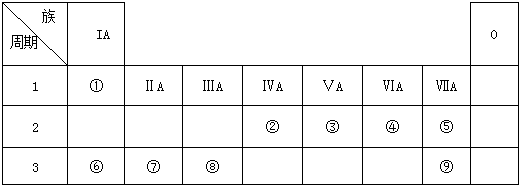
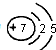 .
.
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
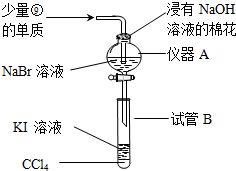
.

 +H2O;
+H2O; 和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式:
和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式: +HC≡C-CH3→
+HC≡C-CH3→ +HI.
+HI.