题目内容
【题目】现用0.1000mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
填空完成问题:
(1)该滴定实验所需的玻璃仪器有___。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.漏斗
(2)不用___(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因__。
(3)滴定终点的现象为__。
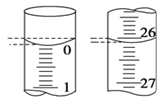
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为__mL,终点读数为__mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol/LKMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为__。
(6)下列操作中可能使测定结果偏低的是__(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
【答案】ADG 碱 高锰酸钾具有强氧化性能腐蚀橡胶管(或高锰酸钾溶液能把橡胶管氧化) 滴入最后一滴高锰酸钾溶液时,溶液从无色变为浅紫色,且半分钟内不恢复原色 0.00 26.10 0.2610mol·L-1 CD
【解析】
(1)酸性高锰酸钾和草酸溶液均需要用酸式滴定管量取;滴定时待测液需盛放在锥形瓶中,还需要烧杯盛放溶液,滴定管夹、铁架台、白纸也需要,但不是玻璃仪器,所以选ADG;
(2)高锰酸钾具有强氧化性能腐蚀橡胶管,所以不用碱式滴定管盛放高锰酸钾溶液;
(3)当达到滴定终点时草酸完全反应,酸性高锰酸钾过量,溶液会显浅紫色,所以滴定终点现象为滴入最后一滴高锰酸钾溶液时,溶液从无色变为浅紫色,且半分钟内不恢复原色;
(4)初始读数为0.00mL,结束时读数为26.10mL;
(5)第二次数据偏差较大,故舍去,所以消耗高锰酸钾溶液的平均体积为![]() =26.10mL,根据反应方程式可知:2MnO4-~5H2C2O4,n(H2C2O4)=
=26.10mL,根据反应方程式可知:2MnO4-~5H2C2O4,n(H2C2O4)=![]() n(MnO4-),即:c(H2C2O4)×0.025L=
n(MnO4-),即:c(H2C2O4)×0.025L=![]() ×0.1000molL-1×0.02610L,解得c(H2C2O4)=0.2610molL-1;
×0.1000molL-1×0.02610L,解得c(H2C2O4)=0.2610molL-1;
(6)A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液,标准液的浓度偏小,消耗的标准液体积偏大,测得的待测液浓度偏大,故A不符合题意;
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥,对消耗的标准液体积无影响,故对测定结果没有影响,故B不符合题意;
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡,使读取的标准液体积偏小,测得的待测液浓度偏低,故C符合题意;
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数,使读取的标准液体积偏小,测得的待测液浓度偏低,故D符合题意;
综上所述选CD。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】A、B、C、D、E是五种短周期主族元素。已知:
元素种类 | 性质 |
A | 短周期主族元素中原子半径最大 |
B | 最高价氧化物对应的水化物是一种两性氢氧化物 |
C | 热稳定性:HmD>HmC |
D | 质子数是A与B之和的 |
E | 原子序数最大的短周期主族元素 |
请回答下列问题:
(1)A元素在周期表中的位置为_____;Cm-的结构示意图为_____。
(2)五种元素的简单离子半径从大到小的顺序为_____(填离子符号)。
(3)A与D形成化合物的水溶液显强碱性,该水溶液不仅能溶解另外三种元素的单质,还能溶解一些化合物,请写出B2D3被溶解的离子方程式:____。