题目内容
5.某学生欲配制6.0mol•L-1的H2SO4溶液950mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol•L-1 的硫酸;②150mL 25%的硫酸(ρ=1.18g•mL-1);③足量的18mol•L-1 的硫酸.有三种规格的容量瓶:250mL、500mL、1 000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充. 请回答下列问题:(1)实验所用25%的硫酸的物质的量浓度为3.0mol•L-1(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为1000 mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的 18mol•L-1的硫酸295.0mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.轻轻摇动,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面最低点恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)如果省略操作D,对所配溶液浓度有何影响?偏小(填“偏大”“偏小”或“无影响”).
(5)进行操作C前还需注意将稀释后的硫酸冷却.
分析 (1)依据C=$\frac{1000ρω%}{M}$计算25%的硫酸的物质的量浓度,设需要浓硫酸的体积为V,依据稀释前后溶液中所含溶质的物质的量不变计算所需浓硫酸的体积V;
(2)依据所配溶液的体积选择合适的容量瓶;
(3)B.所配溶液所需的硫酸的物质的量等于①②两种硫酸溶液含硫酸的总的物质的量加③提供硫酸的物质的量,所以③提供硫酸的物质的量等于所需硫酸总的物质的量减去①②两种硫酸溶液含硫酸的总的物质的量,依据V=$\frac{n}{C}$计算体积;
D.烧杯壁和玻璃棒上都沾有硫酸,为保证全部将溶质转移到容量瓶,应进行洗涤,将洗涤液全部转移到容量瓶中;
(4)依据C=$\frac{n}{V}$,分析D操作对n的影响;
(5)容量瓶为精密仪器,物质在溶解或者稀释会放出大量的热.
解答 解:(1)25%的硫酸的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.18×25%}{98}$=3.0mol/L,故答案为:3.0;
(2)由题意某学生欲配制6.0mol/L的H2SO4 950mL,而实验室无950mL容量瓶,故所以应选择1000mL的容量瓶,故答案为:1000;
(3)欲配制6.0mol/L的H2SO4 1 000mL所需硫酸的物质的量=6.0mol/L×1L=6.0mol,①480mL 0.5mol/L的硫酸中含硫酸的物质的量为0.5mol/L×0.48L=0.24mol;②150mL 25%的硫酸(ρ=1.18g/mL)含硫酸的物质的量为3.0mol/L×0.15L=0.45mol,6.0mol-0.24mol-0.45mol=5.31mol,所以需要18mol/L的硫酸的体积V=$\frac{n}{c}$=$\frac{5.31mol}{18mol/L}$=0.2950L,即295.0mL;
故答案为:295.0;
D.烧杯和玻璃棒,正确的实验操作是:用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
故答案为:用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
(4)依据C=$\frac{n}{V}$,如果省略操作D,则溶质的物质的量n将会偏小,所配溶液的浓度将会偏小,故答案为:偏小;
(5)容量瓶不能受热,故应将将稀释后的硫酸冷却,故答案为:将稀释后的硫酸冷却.
点评 本题考查溶液浓度的计算和一定物质的量浓度溶液的配制,题目难度不大,本题注意配制溶液的操作步骤、仪器以及注意事项,是中学阶段重要的定量实验.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 120g NaHSO4固体中含有的离子总数为3NA | |
| C. | 1mol Na被氧化生成Na2O2或NaCl,都失去NA个电子 | |
| D. | 1.0L 1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤纯碱和熟石灰都是碱
⑥豆浆和雾都是胶体.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥ | D. | ①③④⑥ |
| A. | CO2通入澄清的石灰水中反应的产物 $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ | |
| B. | Fe在Cl2中的燃烧产物: $\frac{n(C{l}_{2})}{n(Fe)}$ $\frac{n(C{l}_{2})}{n(Fe)}$ | |
| C. | AlCl3溶液中滴加NaOH后铝的存在形式: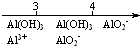 $\frac{n(NaOH)}{n(AlC{l}_{3})}$ $\frac{n(NaOH)}{n(AlC{l}_{3})}$ | |
| D. | 氨水与SO2反应后溶液中的铵盐: $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 |
| A. | 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏 | |
| B. | SO2有强还原性,用SO2漂白纸浆 | |
| C. | 熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带 | |
| D. | 铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物 |
①Ca(OH)2②Al2O3③Ca(HCO3)2④Al(OH)⑤NaHSO4⑥Al⑦(NH4)2S.
| A. | ②④⑥ | B. | ②③⑤⑥ | C. | ①③④⑥ | D. | ②③④⑥⑦ |
| A. | 反应热就是反应中放出的热量 | |
| B. | 当反应放热时△H>0,反应吸热时△H<0 | |
| C. | 一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“-” | |
| D. | 一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,△H为“+” |
 A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.
A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质. .
.