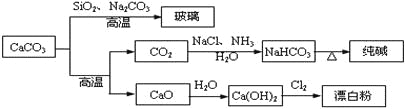
题目内容
【题目】按要求回答下列问题:
(1)N2与O2生成NO的过程如下:
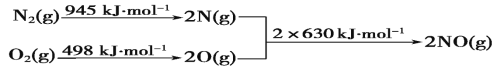
则:N2(g)+O2(g)=2NO(g) ΔH=______________kJ/mol
(2) 已知:甲烷的燃烧热ΔH=-890 kJ/mol,则甲烷完全燃烧的热化学方程式可表示为________________。
(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=________ kJ/mol
【答案】+183 CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol -1168
【解析】
(1)根据反应热等于反应物总键能与生成物总键能的差计算;
(2)甲烷燃烧热表示1 mol甲烷完全燃烧产生CO2气体和液态H2O时放出890 kJ的热量,据此书写热化学方程式;
(3)将(1)(2)的热方程式用序号①②标出,同时写出水蒸气变成液态水时热化学方程式,然后根据盖斯定律,将上述三个热化学方程式叠加,可得待求反应的热化学方程式。
(1)由于反应热等于反应物总键能与生成物总键能的差,所以N2(g)+O2(g)=2NO(g) ΔH=945 kJ/mol+498 kJ/mol-2×630 kJ/mol=+183 kJ/mol;
(2)甲烷燃烧热ΔH=-890 kJ/mol表示1 mol甲烷完全燃烧产生CO2气体和液态H2O时放出890 kJ的热量,则甲烷完全燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol;
(3)根据(1)(2)可知热化学方程式:①N2(g)+O2(g)=2NO(g) ΔH=+183 kJ/mol;②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ,可得③:H2O(g)=H2O(l) ΔH=-44 kJ/mol,根据盖斯定律,将②-①×2-③×2,整理可得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1168 kJ/mol。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变