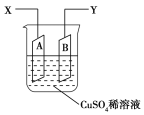
题目内容
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法错误的是( )
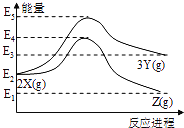
A. 由![]() 反应的ΔH >0
反应的ΔH >0
B. 由![]() 反应的ΔH = (E2-E1) kJ/mol
反应的ΔH = (E2-E1) kJ/mol
C. 降低压强有利于提高Y的产率
D. 降低温度有利于提高Z的产率
【答案】B
【解析】A、由图像可知,2X的能量小于3Y的能量,故X→Y的反应是吸热反应,ΔH >0,故A正确;
B、根据化学反应的实质,化学反应的焓变只与反应物的总能量和生成物的总能量的相对大小有关,与反应途径及活化能无关,又因为2X的能量大于Z的能量,故由X→Z反应的△H= -(E2-E1) kJ/mol,故B错误;
C、根据化学反应2X(g) ![]() 3Y(g),该反应是气体增加的可逆反应,降低压强,平衡正向移动,有利于提高Y的产率,故C正确;
3Y(g),该反应是气体增加的可逆反应,降低压强,平衡正向移动,有利于提高Y的产率,故C正确;
D、由B分析可知,2X(g) ![]() Z(g)是放热反应,降低温度,平衡正向移动,Z的产率升高,故D正确;
Z(g)是放热反应,降低温度,平衡正向移动,Z的产率升高,故D正确;
所以此题答案选B。

 巧学巧练系列答案
巧学巧练系列答案【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g) + 2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H2
CH3OH(g) + H2O(g) △H2
③CO2(g) + H2(g)![]() CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=_____kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_______kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_____;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母)。
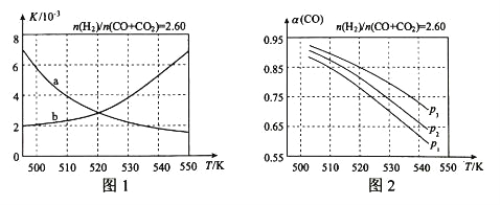
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α与温度和压强的关系如图2所示。 α(CO)值随温度升高而_______(填“增大”或“减小”)。图2中的压强由大到小为___________________。