题目内容
5.(1)配制Na2S溶液时,为了防止发生水解,可以加入少量的NaOH溶液(2)相同物质的量浓度的六种溶液:①Na2CO3;②NaCl;③NaHSO4;④CH3COONa;⑤H2SO4;⑥NaOH.按pH由大到小的顺序排列为(填写编号)⑥>①>④>②>③>⑤.
(3)室温下,下列五种溶液中:①pH为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH为11的氨水;⑤0.001mol/L的NH4Cl溶液.由水电离的产生的c(H+)由小到大的顺序是(填写编号)①<②<③<④<⑤.
(4)常温下,将0.1mol/L的HCN溶液与0.1mol/L 的NaCN溶液等体积混合,溶液中c(HCN)>c(CN-).
(混合溶液忽略体积的变化)则该混合溶液的PH>7(填“>、<、=”,下同);
c(HCN)+c(CN-)=0.1mol/L $\frac{c(HCN)-c(C{N}^{-})}{2}$<c (OH-)
分析 (1)Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,为防止水解,应该加入少量碱,据此分析解答;
(2)酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小;
(3)电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,据此计算出各项水电离的氢离子浓度;
(4)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒,据此分析解答.
解答 解:(1)Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,水解方程式为S2-+H2O?HS-+OH- HS-+H2O?H2S+OH-,为了防止水解且不引进其它杂质,可以向溶液中加入少量NaOH,故答案为NaOH;
(2)酸性溶液;⑤H2SO4为二元强酸;
③NaHSO4溶液中,溶液中电离出氢离子,溶液显示酸性;溶液的pH:⑤<③,
碱性溶液:
⑥NaOH为一元强碱;
①Na2CO3为强碱弱酸盐,溶液显示碱性;
④CH3COONa为强碱弱酸盐,溶液显示碱性,由于酸性醋酸大于碳酸,则醋酸根离子的水解程度小于碳酸根离子,则醋酸钠溶液中氢氧根离子浓度小于碳酸钠,溶液的pH:④<①;
溶液的pH:⑤<③<④<①<⑥;
②NaCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由大到小的排列顺序是:⑥>①>④>②>③>⑤;
故答案为:⑥>①>④>②>③>⑤;
(3)酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为:$\frac{1×1{0}^{-14}}{1}$mol/L=1×10-14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢氧根离子为:$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L;
④pH=11的氨水溶液,溶液中氢离子浓度为:1×10-11mol/L;
⑤0.001mol/L的NH4Cl溶液中,铵根离子水解促进水的电离,溶液中氢离子浓度增大,
所以由水电离产生的c(H+)之比,由小到大的顺序是①<②<③<④<⑤,
故答案为:①<②<③<④<⑤;
(4)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,则pH>7,
溶液中存在物料守恒,根据物料守恒得c(HCN)+c(CN-)=0.1mol/L,
溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)、存在物料守恒2c(Na+)=c(HCN)+c(CN-),所以得c(HCN)+2c(H+)=2c(OH-)+c(CN-),$\frac{c(HCN)-c(C{N}^{-})}{2}$=c(OH-)-c(H+)<c(OH-),
故答案为:>;=;<.
点评 本题考查了水的电离,题目难度中等,解题关键是合理判断酸碱溶液中水电离情况分析及计算方法,注意酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.


| A. | 羧基 | B. | 氨基 | C. | 羟基 | D. | 醛基 |
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2bkJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4bkJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=bkJ/mol |
| A. | 一定条件下, 水解的产物之一是 水解的产物之一是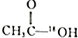 | |
| B. | 油脂的水解又称为皂化,其产物之一高级脂肪酸可用于制造肥皂 | |
| C. | 丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 | |
| D. | 蔗糖、麦芽糖分子式都为C12H22O11,均能发生银镜反应 |
| A. | 乙烯、甲苯、苯酚均能与溴水反应 | |
| B. | 乙炔、苯、苯酚均能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇、苯酚、乙酸都能与氢氧化钠溶液反应 | |
| D. | 乙醇、苯酚、乙酸都能与钠反应,且在相同条件下剧烈程度依次增大 |

| A. | 给液体加热 | B. | 称取NaOH固体 | C. | 转移溶液 | D. | 量取液体 |
| A. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=2﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 产物B的状态只能为固态或液态 |