题目内容
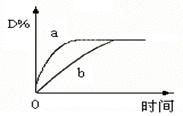
反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断

A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a,b大小
 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断

A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a,b大小
B
根据图像可知,随温度的升高,G的含量逐渐降低,说明升高温度,平衡向正反应方向移动,因此正反应是吸热反应,A不正确,B正确。当温度相同时,压强越大G的含量越高,说明增大压强,平衡向逆反应方向移动,所以a小于b,选项CD不正确,答案选B。

练习册系列答案
相关题目
 CO2(g) + H2(g)达到平衡,在其他条件不变的情况下,下列措施不能使正反应速率加快的是 ( )
CO2(g) + H2(g)达到平衡,在其他条件不变的情况下,下列措施不能使正反应速率加快的是 ( ) 2NO,下列条件能加快其反应速率的是
2NO,下列条件能加快其反应速率的是 C(g)+D(g)在一定条件下已达到平衡的事实是
C(g)+D(g)在一定条件下已达到平衡的事实是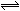 C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是( )