题目内容
5.按要求写出下列式子(1)一水合氨的电离方程式:NH3•H2O?NH4++OH-;
(2)碳酸氢钠的电离方程式:NaHCO3=Na++HCO3-;
(3)氯化铁水解的离子方程式:Fe3++3H2O?Fe(0H)3+3H+;
(4)醋酸钠水解的化学方程式:CH3COONa+H2O?CH3COOH+NaOH;
(5)碘化铅PbI2沉淀溶解平衡的表示式:PbI2?Pb2++2I-.
分析 (1)一水合氨为弱电解质,部分电离,用可逆号;
(2)碳酸氢钠为强电解质,完全电离;
(3)三价铁离子为弱碱阳离子,水溶液中部分发生水解生成氢氧化铁和氢离子;
(4)醋酸钠为强碱弱酸盐,水溶液中水解生成醋酸与氢氧化钠;
(5)碘化铅为难溶物,水溶液中部分溶解.
解答 解:(1)一水合氨为弱电解质,部分电离,电离方程式;NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(2)碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++HCO3-,
故答案为:NaHCO3=Na++HCO3-;
(3)氯化铁水解的离子方程式;Fe3++3H2O?Fe(0H)3+3H+,
故答案为:Fe3++3H2O?Fe(0H)3+3H+;
(4)醋酸钠为强碱弱酸盐,水溶液中水解生成醋酸与氢氧化钠,化学方程式:CH3COONa+H2O?CH3COOH+NaOH,
故答案为:CH3COONa+H2O?CH3COOH+NaOH;
(5)碘化铅为难溶物,水溶液中部分溶解,离子方程式:PbI2?Pb2++2I-,
故答案为:PbI2?Pb2++2I-;
点评 本题考查了离子方程式、化学方程式的书写,涉及盐类的水解、电解质的电离、沉淀的溶解平衡,明确物质的性质及水解、电离方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
16.某短周期元素原子的最外电子层只有2个电子,该元素可能是( )
| A. | 0族元素 | B. | IIA族元素 | C. | 第二周期元素 | D. | IVA族元素 |
13.下列鉴别物质的方法中,不正确的是( )
| A. | 用澄清石灰水鉴别SO2和CO2 | |
| B. | 用KSCN溶液鉴别FeCl2和FeCl3溶液 | |
| C. | 用焰色反应鉴别NaCl溶液和KCl溶液 | |
| D. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 |
20.现有0.1L pH=5的某溶液,要使溶液的pH增加到8,可采用的方法是( )
| A. | 加水稀释到100L | B. | 与0.1L pH=11的碱溶液混合 | ||
| C. | 加入一定量酸 | D. | 加入一定量碱 |
14.下列说法正确的是( )
| A. | 海南岛四面环海,水资源丰富,不必节约用水 | |
| B. | 水体富营养化是因为水体中植物营养物质过多蓄积而引起的污染 | |
| C. | 可通过长期饮用含Ca2+浓度较高的水来补钙 | |
| D. | 长期饮用纯净水更科学 |
12.下列装置能达到实验目的是( )
| A. | 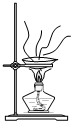 用装置蒸发、结晶制取粗盐 | B. | 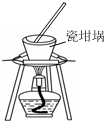 用装置加热熔融NaOH固体 | ||
| C. | 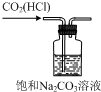 用装置除去CO2中的少量HCl | D. | 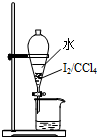 用装置进行萃取、分液 |
 如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.