题目内容
14.下列实验现象和原因都正确且有因果关系的是( )| 选项 | 实验操作及现象 | 产生现象的原因 |
| A | 在氯化银浊液中滴加几滴稀KI溶液,白色沉淀变黄色 | 氯化银的溶度积小于碘化银的溶度积 |
| B | 在新制的氯水中滴加紫色石蕊溶液,溶液先变红色后褪色 | 氯水中有次氯酸,先电离出H+,使石蕊变红;后氧化有色物质 |
| C | 氨气通入酚酞溶液中,溶液变红色 | 氨气是一种碱,在水中电离出OH- |
| D | 借助导线,铜片和锌片在稀硫酸中构成原电池的两个电极,铜极表面产生气泡,锌极溶解 | 锌比铜活泼,锌失去电子,电子经外电路流向铜片,氢离子从铜片获得电子,最终产生氢气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生沉淀的转化,向溶度积更小的方向移动;
B.氯水中含HCl、HClO,HClO具有漂白性;
C.一水合氨为弱碱,电离显碱性;
D.原电池中Zn为负极,Cu为正极,电子从负极流向正极.
解答 解:A.由现象可知发生沉淀的转化,向溶度积更小的方向移动,则氯化银的溶度积大于碘化银的溶度积,故A错误;
B.氯水中含HCl、HClO,HClO具有漂白性,则盐酸电离显酸性,使石蕊变红,后HClO氧化有色物质褪色,故B错误;
C.由现象可知一水合氨为弱碱,电离显碱性,而氨气不是碱,故C错误;
D.由现象可知锌失去电子,电子经外电路流向铜片,氢离子从铜片获得电子,最终产生氢气,因原电池中Zn为负极,Cu为正极,电子从负极流向正极,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及沉淀转化、原电池、物质的性质等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列各项所述内容对应的图象不正确的是( )
| A. |  向Ba(OH)2溶液中加稀H2SO4 | B. | 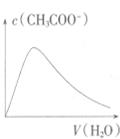 向冰醋酸中加蒸馏水 | ||
| C. |  向稀NaOH溶液中加稀盐酸 | D. | 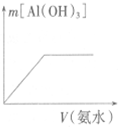 向AlCl3溶液中加氨水 |
2.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.以Al-H2O2燃料电池电解尿素的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下列说法不正确的是( )


| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
9.氯气常用于饮用水杀菌消毒,已知HClO杀菌能力比ClO-强,经测定25℃,pH=7.5时c(HClO)=c(ClO-),下列有关说法不正确的是( )
| A. | 新制的氯水中存在c(H+)>c(Cl-)=c(HClO)+c(ClO-) | |
| B. | 25℃时,H++ClO-?HClO的平衡常数K=1.0×10-7.5 | |
| C. | 氯气处理饮用水时,pH=5.5的效果比pH=7.5的好 | |
| D. | 新制的氯水中存在c(H+)═c(Cl-)+c(ClO-)+c(OH-) |
19.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
20.下列关于元素周期表的结构的叙述中正确的是( )
| A. | 除短周期外,其他周期均有18种元素 | |
| B. | 副族元素中没有非金属元素 | |
| C. | 周期表中的第三列是ⅢA | |
| D. | 在过渡元素区能找到大量单质半导体材料 |
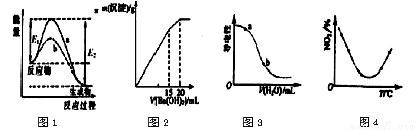
 N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0