题目内容
3.下列反应说明氨气既有还原性,又有碱性的是( )| A. | NH3+H2O?NH3•H2O | B. | 3Cl2+8NH3═N2+6NH4Cl | ||
| C. | 3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | NH3+HNO3═NH4NO3 |
分析 还原性是指元素化合价上升,碱性是指能跟酸性物质反应.NH3中N的化合价为-3价,H的化合价为+1价,说明氨气具有还原性,只能是NH3中-3价的N化合价上升,说明氨气具有碱性,是指NH3能跟酸性物质反应.
解答 解:A.NH3+H2O?NH3•H2O反应中没有元素化合价的变化,不是氧化还原反应,故A错误;
B.3Cl2+8NH3=N2+6NH4Cl反应的本质为3Cl2+2NH3=N2+6HCl①,过量的NH3与HCl反应,HCl+NH3=NH4Cl②,将①+②×6得:3Cl2+8NH3=N2+6NH4Cl,①为氧化还原反应,NH3中-3价的N被Cl2氧化,氧化产物为N2,②为非氧化还原反应,NH3跟酸性气体HCl物质反应,故B正确;
C.3CuO+2NH3=3Cu+N2+3H2O中NH3-3价的N被CuO氧化,氧化产物为N2,N2化合价为0价,氨气具有还原性,不能说明氨气显碱性,故C错误;
D.NH3+HNO3=NH4NO3中反应前后化合价未变,该反应不是氧化还原反应,不合题意,故D错误.
故选B.
点评 本题考查了氧化还原反应,能根据化合价变化判断该反应为氧化还原反应,化合价升高的元素被氧化.碱性是指能跟酸性物质反应.平时应培养综合运用各知识点的能力,题目难度不大.

练习册系列答案
相关题目
13.沸腾时只需克服范德华力的液体物质是( )
| A. | 水 | B. | 酒精 | C. | 氨水 | D. | CH3Cl |
14.在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断错误的是( )


| A. | NaOH的浓度为0.6 mol•L-1 | B. | 在a点处溶液中的溶质为NaCl | ||
| C. | 混合溶液中n(Al3+):n(Mg2+)=2:1 | D. | 图中线段oa:ab=5:1 |
11.下列有机物的一氯代物只有2种的是( )
| A. |  | B. |  | C. |  | D. |  |
18.下列既含有离子键又含有共价键的化合物是( )
| A. | H20 | B. | MgCl2 | C. | HNO3 | D. | Na2O2 |
8.下列说法中正确的是( )
| A. | 由于分子间作用力的存在,因而CO2在加热条件下不易发生分解 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 在PCl3分子中各原子都达到8电子稳定结构 | |
| D. | 离子化合物中可能存在共价键,共价化合物中也可能存在离子键 |
15.某同学为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能检验出一定存在的离子是( )
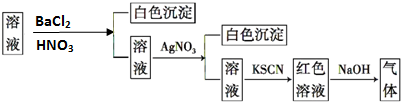

| A. | SO42-、NH4+ | B. | Cl- | C. | Fe3+ | D. | NH4+ |
12.下列关于SO2性质的说法中,正确的是( )
| A. | 能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| B. | 能使澄清石灰水变浑浊 | |
| C. | 不能与NaOH溶液反应 | |
| D. | 能与水反应生成硫酸 |
13.物质的分离、提纯是中学化学的重要操作,请应用物质分离、提纯知识,分离下列各组混合物.
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |