题目内容
对某酸性溶液(可能含有Br-、SO①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是
A.Br- B.SO![]() C.H2SO3 D.NH
C.H2SO3 D.NH![]()
解析:①说明含有H2SO3;②说明含有NH![]() ;③略显黄色,说明含有Br-;产生白色沉淀不能说明含有SO
;③略显黄色,说明含有Br-;产生白色沉淀不能说明含有SO![]() ,因H2SO3+Cl2+H2O====H2SO4+2HCl。
,因H2SO3+Cl2+H2O====H2SO4+2HCl。
答案:B

某化学兴趣小组在实验室对某固体催化剂(可能含有FeO、Fe2O3中的一种或两种)中铁元素的价态进行探究(已知:Fe2+能使高锰酸钾的酸性溶液褪色,反应式为:5 Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
(1)将该固体催化剂在稀硫酸中溶解,请写出这两种氧化物与稀硫酸反应的离子方程式:
、 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
3 mol·L-1H2SO4,3% H2O2、6 mol·L-1HNO3、饱和氯水、0.01 mol·L-1KmnO4、0.1 mol·L-1KI、20% KSCN溶液、蒸馏水。
①提出合理假设
假设1: ;
假设2: ;
假设3:催化剂中铁元素的价态既有+3价又有+2价。
①设计实验方案证明你的假设(不要在答题卡上作答)
②实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中。 | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+。 |
| 步骤2: | |
| 步骤3: | |
| … |
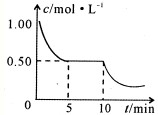
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.