题目内容
将N2和H2按1:3的体积比装入一密闭容器中在400℃和10kPa下达到平衡时,NH3的体积百分数为39%,求此时三种物质的物质的量之比.
考点:化学方程式的有关计算
专题:计算题
分析:发生反应N2(g)+3H2(g)?2NH3(g),N2和H2按1:3的体积比混合,二者按1:3反应,故平衡后N2和H2的体积分数之比为1:3,利用氨气的体积分数计算N2和H2的体积分数之和,进而计算各自的体积分数,N2、H2、NH3的物质的量之比等于体积分数之比.
解答:
解:发生反应N2(g)+3H2(g)?2NH3(g),N2和H2按1:3的体积比混合,二者按1:3反应,故平衡后N2和H2的体积分数之比为1:3,
平衡后,氨气的体积分数为39%,故N2和H2的体积分数之和=1-39%=61%,
则N2的体积分数之和=61%×
=15.25%,
H2的体积分数之和=61%×
=45.75%,
平衡时N2、H2、NH3的物质的量之比等于体积分数之比=15.25%:45.75%:39%=61:183:156,
答:平衡时N2、H2、NH3的物质的量之比为61:183:156.
平衡后,氨气的体积分数为39%,故N2和H2的体积分数之和=1-39%=61%,
则N2的体积分数之和=61%×
| 1 |
| 1+3 |
H2的体积分数之和=61%×
| 3 |
| 1+3 |
平衡时N2、H2、NH3的物质的量之比等于体积分数之比=15.25%:45.75%:39%=61:183:156,
答:平衡时N2、H2、NH3的物质的量之比为61:183:156.
点评:本题考查化学平衡有关计算,难度中等,充分利用氮气与氢气的起始体积之比与化学计量数之比确定平衡时二者体积分数关系,简化计算过程,也可以利用三段式计算.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
 它可通过不同化学反应分别制得B、C、D和E四种物质.
它可通过不同化学反应分别制得B、C、D和E四种物质.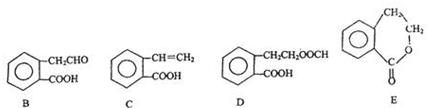
 、HCOOH、CH3COOC2H5
、HCOOH、CH3COOC2H5
 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答: