题目内容
下列离子方程式表示错误的是( )
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| B、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O |
| C、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+3H+ |
| D、铜片加入稀硝酸中:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合碳酸氢根离子全部反应;
B、铁离子氧化碘离子为碘单质;
C、氢氧化铜胶体是均一的分散系;
D、铜和稀硝酸反应生成硝酸铜、一氧化氮、水.
B、铁离子氧化碘离子为碘单质;
C、氢氧化铜胶体是均一的分散系;
D、铜和稀硝酸反应生成硝酸铜、一氧化氮、水.
解答:
解:A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合碳酸氢根离子全部反应,HCO3-+Ba2++OH-═BaCO3↓+H2O,故A正确;
B、铁离子氧化碘离子为碘单质,Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O,故B正确;
C、氢氧化铁胶体是均一的分散系,三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体:Fe3++3H2O
Fe(OH)3+3H+,故C错误;
D、铜和稀硝酸反应生成硝酸铜、一氧化氮、水,反应的离子方程式:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D正确;
故选C.
B、铁离子氧化碘离子为碘单质,Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O,故B正确;
C、氢氧化铁胶体是均一的分散系,三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体:Fe3++3H2O
| ||
D、铜和稀硝酸反应生成硝酸铜、一氧化氮、水,反应的离子方程式:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D正确;
故选C.
点评:本题考查了离子方程式书写方法和正误判断,主要是铁离子的氧化性,胶体制备的分析,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知,单质碘受热易升华.从海带中提取碘的实验过程中,涉及下列实验操作步骤,关于各步骤的实验目的或实验操作,描述正确的是( )
A、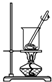 将海带灼烧成灰 |
B、 过滤得含I-的溶液 |
C、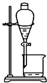 下层放出碘的苯溶液 |
D、 分离碘并回收苯 |
某溶液只含有①NO3-、②HCO3-、③SO32-、④CO32-、⑤SO42-、⑥Na+六种离子.向其中加入少量的Na2O2固体后,溶液中离子的物质的量不变的是( )
| A、①③④⑤⑥ | B、①⑤⑥ |
| C、①④⑤ | D、① |
在下列反应中:aFeS+bH2SO4(浓)→cFe2(SO4)3+dSO2+eS↓+6H2O,a、b数值是( )
| A、a=2,b=6 |
| B、a=4,b=18 |
| C、a=6,b=16 |
| D、a=8,b=18 |
下列分子式表示的物质,具有同分异构体的是( )
| A、C2H5Cl |
| B、C3H8 |
| C、CH2Cl2 |
| D、C2H4Cl2 |
恒温下,将1mol N2和3mol H2在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s时测得NH3的体积分数为25%.则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2 mol?L-1?s-1 |
| B、2 s时N2的转化率为40% |
| C、2 s时混合气体中n(N2)?n(H2)?n(NH3)=3:9:4 |
| D、2 s 时NH3的浓度为0.4 mol?L-1 |
浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl其溶液的pH由小到大的顺序是( )
| A、②①③⑧⑦⑥⑤④ |
| B、①②③⑧⑦⑥⑤④ |
| C、②①③⑦⑧⑥⑤④ |
| D、②①③⑧⑦⑥④⑤ |
有X、Y、Z三种金属,能发生以下置换反应:则X、Y、Z三种金属的活动性由强到弱的顺序可排列为( )
①X+H2SO4=XSO4+H2↑ ②Y+HCl→不能反应 ③Z+XSO4=ZSO4+X.
①X+H2SO4=XSO4+H2↑ ②Y+HCl→不能反应 ③Z+XSO4=ZSO4+X.
| A、X、Y、Z |
| B、X、Z、Y |
| C、Y、Z、X |
| D、Z、X、Y |
下列不属于硅酸盐产品的是( )
| A、水泥 | B、砖瓦 | C、陶瓷 | D、硫酸 |