题目内容
铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的硫酸和NaOH物质的量之比为
| A.1:1 | B.3:1 | C.3:2 | D.1:3 |
C
解析试题分析:反应的有关方程式为:铝与盐酸:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;假设生成的氢气的物质的量为3mol,根据方程式计算NaOH、HCl的物质的量,从而计算出氢氧化钠和氯化氢物质的量的之比。设生成的氢气的物质的量为3mol,则:
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
所以所取氢氧化钠和盐酸溶液中NaOH、HCl的物质的量的之比为2mol:6mol=1:3,因此答案选C。
考点:考查铝与氢氧化钠溶液以及盐酸反应的计算

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的液度为( )
| A.0.5 mol/L | B.1.0 mol/L | C.2.0 mol/L | D.3.0 mol/L |
硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
| A.锌粉 | B.镁粉 | C.铁粉 | D.铝粉 |
下列有关金属及其化合物的说法中正确的是
| A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O |
B.钠在空气中燃烧生成淡黄色的 |
| C.铁在高温下与水蒸气反应生成Fe2O3和H2 |
| D.用碳酸钠和氢氧化钙反应制NaOH |
除去Na2CO3固体中少量NaHCO3的最佳方法是
| A.加入适量盐酸 | B.加热 | C.加入NaOH溶液 | D.配成溶液后通入CO2 |
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是( )
| A.1mol/L | B.2mol/L | C.3mol/L | D.4mol/L |
下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是( )
| A.NH4Al(SO4)2 | B.KAl(SO4)2 | C.Al2(SO4)3 | D.NaAlO2 |
在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )
| A.Fe2O3、Al2O3 | B.Fe2O3 |
| C.Fe (OH)2、Al(OH)3 | D.Fe(OH)3、Al(OH)3 |
将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.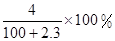 | B.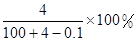 |
C.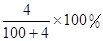 | D.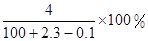 |