题目内容
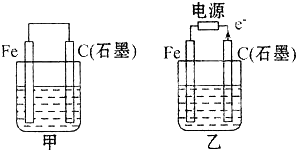
如图甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为______;
②乙中总反应的离子方程式为______;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为______.
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为______.
②如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______(填写物质的化学式)______ g.
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为______;
②乙中总反应的离子方程式为______;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为______.
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为______.
②如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______(填写物质的化学式)______ g.

(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,
则电解反应为2Cl-+2H2O
H2↑+Cl2↑+2OH-,
故答案为:2Cl-+2H2O
H2↑+Cl2↑+2OH-;
③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,
所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②由2CuSO4+2H2O
2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,
n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,
m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).
故答案为:2H2O+O2+4e-═4OH-;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,
则电解反应为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,
所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②由2CuSO4+2H2O
| ||
n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,
m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.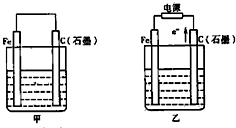 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置. 如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )
如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )