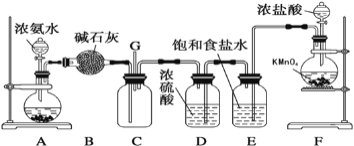
题目内容
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
【答案】2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/molad0.042mol·L-1·min-1
N2(g)+2CO2(g) △H=-747 kJ/molad0.042mol·L-1·min-1![]() >正向60%
>正向60%
【解析】
(1)依据平衡常数表达式书写热化学方程式,结合已知的热化学方程式和盖斯定律计算得到缩小热化学方程式的焓变,得到此反应的热化学方程式;
(1)若某反应的平衡常数表达式为:k=![]() ,反应为2NO(g)+2CO(g)
,反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),①2C(s)+O 2(g)=2CO(g)△H=-221kJmol-l
N2(g)+2CO2(g),①2C(s)+O 2(g)=2CO(g)△H=-221kJmol-l
②C(s)+O2(g)=CO2(g)△H=-393.5kJmol-l,
③N2(g)+O2(g)=2NO(g)△H=+181kJmol-l,
盖斯定律计算②×2-③-①得到2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-747 kJmolˉ1; 由于该反应为气体体积减小的放热反应,a.增大容器压强平衡正向移动NO转化率增大,故正确;b.升高温度平衡逆向移动,NO转化率减小,故错误;c.使用优质催化剂不能改变平衡,故错误;d.增大CO的浓度,可以提高NO的转化率,故正确;答案选ad; (2)根据盖斯定律:上述已知反应②-①得:C(s)+2NO(g)
N2(g)+2CO2(g)△H=-747 kJmolˉ1; 由于该反应为气体体积减小的放热反应,a.增大容器压强平衡正向移动NO转化率增大,故正确;b.升高温度平衡逆向移动,NO转化率减小,故错误;c.使用优质催化剂不能改变平衡,故错误;d.增大CO的浓度,可以提高NO的转化率,故正确;答案选ad; (2)根据盖斯定律:上述已知反应②-①得:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-574.5kJmol-l,①利用表格数据: 0~5min内,以N2表示的该反应速率v(N2)=
N2(g)+CO2(g) △H=-574.5kJmol-l,①利用表格数据: 0~5min内,以N2表示的该反应速率v(N2)=![]() ,所以以CO2表示的该反应速率v(CO2)= v(N2)
,所以以CO2表示的该反应速率v(CO2)= v(N2)![]() ,通过分析知10min后浓度不再改变,处于平衡状态,用三段式分析浓度改变
,通过分析知10min后浓度不再改变,处于平衡状态,用三段式分析浓度改变
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
10min时平衡浓度(mol/L) 0.4 0.3 0.3
平衡常数K=![]() ;②第15 min后,温度调整到T2,从表格查得NO减少,N2增加,平衡正向移动,由于反应为放热反应,改变条件为除温,则T1>T2;
;②第15 min后,温度调整到T2,从表格查得NO减少,N2增加,平衡正向移动,由于反应为放热反应,改变条件为除温,则T1>T2;
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,此时各量分析如下:
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
30min时平衡浓度(mol/L) 0.2 0.4 0.4
加入混合物后浓度(mol/L) 1.2 1.4 1.4
变化浓度(mol/L) 2x x x
新平衡浓度(mol/L) 1.2-2x 1.4+x 1.4+x
T2时平衡常数K=![]() ,加入混合物后Qc=
,加入混合物后Qc=![]() ,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:
,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:![]() ,解得x=0.2;经计算NO超始总量为2mol+2mol=4mol,达到平衡时NO的物质的量为(1.2-2
,解得x=0.2;经计算NO超始总量为2mol+2mol=4mol,达到平衡时NO的物质的量为(1.2-2![]() mol/L
mol/L![]() 2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=
2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=![]() 。
。

【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________(用元素符号表示),元素Z的离子结构示意图为__________。
(2)元素Y与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是____________________。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: ____________________。
(4)元素X与元素Y相比,非金属性较强的是__________(用元素符号表示)。
(5)探寻物质的性质差异性是化学学习的重要方法之一。X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是__________(用元素符号表示),理由是_____________________。