题目内容
11.六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O72-常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O72-的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+.(1)写出Fe2+还原Cr2O72-的离子方程式,并标明电子转移的方向和数目:
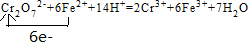 .
.(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=1.5.
(3)Cr3+在过量的NaOH溶液中会转化为CrO2-,写出这一转化的离子方程式Cr3++4OH-=CrO2-+2H2O,由此可知Cr(OH)3呈两(选填“酸”、“碱”或“两”)性.
分析 (1)Fe元素的化合价升高,Cr元素的化合价降低,结合电子、电荷守恒分析;
(2)Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4中正负化合价的倒数和为0;
(3)类似铝离子与碱的反应,由此分析解答.
解答 解:(1)Fe2+还原Cr2O72-的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,Fe失去电子,Cr得到电子,该反应转移6e-,电子转移的方向和数目为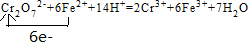 ,
,
故答案为: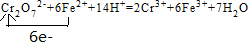 ;
;
(2)Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4中正负化合价的倒数和为0,则+2+3x+3×(2-x)+(-2)×4=0,解得x=1.5,故答案为:1.5;
(3)Cr3+在过量的NaOH溶液中会转化为CrO2-,这一转化的离子方程式为Cr3++4OH-=CrO2-+2H2O,由此可知Cr(OH)3呈两性,
故答案为:Cr3++4OH-=CrO2-+2H2O;两.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
1.下列溶液中跟100mL 0.1mol/L 硫酸钾溶液里钾离子物质的量浓度相同的是( )
| A. | 100 mL 0.2 mol/L 氯化钾溶液 | B. | 200 mL 0.1 mol/L 硝酸钾溶液 | ||
| C. | 100 mL 0.1 mol/L 硝酸钾溶液 | D. | 50 mL 0.2 mol/L 磷酸钾溶液 |
19.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法错误的是( )
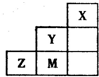

| A. | Y、Z可形成ZY6分子 | B. | X晶体属于原子晶体 | ||
| C. | 原子半径:Z>M>Y | D. | Z离子的结构示意图可表示为: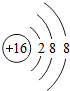 |
6.下列化学名词正确的是( )
| A. | 三溴笨酚 | B. | 烧碱 | C. | 硬脂酸甘油脂 | D. | 石碳酸 |
16.将下列物质分别加入溴水中,溴水的颜色不发生变化的是( )
| A. | NaI固体 | B. | KCl固体 | C. | CCl4液体 | D. | NaOH固体 |
3.下列变化会放出热量的是( )
| A. | 碘升华 | B. | 冰融化 | C. | 氯化铵溶于水 | D. | 氢氧化钠溶于水% |
20.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
则下列说法正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.015mol |
1.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 铜粉溶解于1L0.5mol•L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA | |
| B. | 标准状况下,22.4LSO3的分子数为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,生成了0.2molO2,转移电子的数目为0.8 NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2. )需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.
)需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.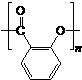 .
. 制备A的合成路线.
制备A的合成路线.