题目内容
【题目】用无水Na2CO3配制250 mL 1.000 mol·L-1 Na2CO3溶液时,下列操作会使配制的溶液浓度偏大的是
A.称量时碳酸钠固体含有结晶水B.溶液未冷却立即定容
C.定容时俯视容量瓶刻度线D.容量瓶没有干燥
【答案】BC
【解析】
A.称量时碳酸钠固体含有结晶水,则碳酸钠的物质的量偏小,溶液浓度偏低,故A不符合题意;
B.溶液未冷却立即定容,恢复至室温时,溶液体积减小,溶液浓度偏高,故B符合题意;
C.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故C符合题意;
D.容量瓶没有干燥,对溶质的物质的量和溶液体积都不影响,溶液浓度无影响,故D不符合题意;
答案选BC。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如图所示。
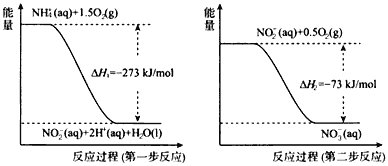
①第一步反应是____(填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是______。
(2)已知,H2(g)+Br2(l)=2HBr (g) △H=-72kJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
物质 | H2(g) | Br2(g) | HBr (g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_____。
(3)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH= -196.6 kJ·mol-1
2SO3(g) ΔH= -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0 kJ·mol-1
2NO2(g) ΔH= -113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ·mol-1;
SO3(g)+NO(g)的ΔH=____kJ·mol-1;