题目内容
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
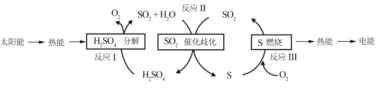
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
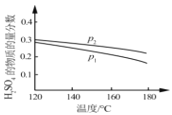
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

【答案】3SO2(g)+2H2O (g)=2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1 BCE 随着分离 H2次数的增加,HI的转化率逐渐提高,但提高幅度逐渐减小 0.165 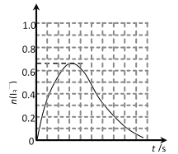 (最高点为 0.67)
(最高点为 0.67)
【解析】
根据盖斯定律分析判断即可;结合影响平衡移动的因素分析,注意催化剂不改变平衡移动;根据减小生成物的浓度促进平衡正向移动分析。
(1)①反应Ⅰ:2H2SO4(l)═2SO2(g)+2H2O(g)+O2(g)△H1=+551kJmol-1,反应Ⅲ:S(s)+O2(g)═SO2(g)△H3=-297kJmol-1,结合盖斯定律可知,-I-III得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),其△H=-(+551kJmol-1)-(-297kJmol-1)=-254kJ/mol,则反应Ⅱ的热化学方程式为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)△H=-254kJ/mol;
②A.增大压强平衡正向移动,硫酸的物质的量增大,由图可知,p2对应硫酸物质的量分数大,则p2>pl;反应Ⅱ为气体体积减小的反应,则△S<0,故A正确;
B.催化剂对平衡移动无影响,则催化剂不能提高H2SO4在平衡体系中物质的量分数,故B错误;
C.投料比【n(SO2):n(H2O)】改变为2:1,对比投料比【n(SO2):n(H2O)】为3:2时,相当于增大二氧化硫的物质的量,促进水的转化,但SO2的平衡转化率减小,故C错误;
D.气体的体积一定,混合气体的总质量不确定,当容器内气体的密度不变时,说明混合气体总质量一定,则可判断反应达到平衡状态,故D正确;
E.反应Ⅱ为放热反应,温度升高,有利于反应速率加快,但平衡逆向移动,SO2的平衡转化率降低,K 值变小,故E错误;
故答案为BCE;
(2)①分离出氢气,有利于平衡向正反应方向移动,随着分离氢气次数的增加,HI的转化率逐渐提高,但提高幅度逐渐减小;
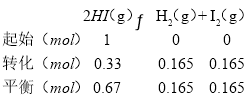
故2次平衡时I2的物质的量为n(I2)=0.165mol;
②将SO2的通入I2的水溶液,反应生成I-,生成的I-与I2结合得到I3-,随反应进行I3-物质的量增大,由I原子守恒可知I3-的最大物质的量为![]() ≈0.67mol,继续通入SO2,I2(aq)+I-(aq)
≈0.67mol,继续通入SO2,I2(aq)+I-(aq)![]() I3-(aq)平衡向左移动,I3-物质的量减小,由SO2+I2+2H2O=2HI+H2SO4可知,二氧化硫与碘单质恰好完全反应,故最终I3-物质的量为0,溶液中I3-的物质的量n(I3-)随反应时间t变化的曲线图为:
I3-(aq)平衡向左移动,I3-物质的量减小,由SO2+I2+2H2O=2HI+H2SO4可知,二氧化硫与碘单质恰好完全反应,故最终I3-物质的量为0,溶液中I3-的物质的量n(I3-)随反应时间t变化的曲线图为: 。
。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案