题目内容
14.短周期的A、B两种元素,A原子序数小于B,两种元素可形成A是正价的AB2型化合物.下列关于两元素的叙述正确的是( )①A、B可能属于同一周期
②A是B的前一周期元素;
③A只能是金属元素;
④A可能是第二周期ⅡA族或ⅣA族元素.
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ②③④ |
分析 短周期的A、B两种元素,如果同周期,A原子序数小于B,A为正价;不同周期A原子序数小于B,则A应在第二周期,B在在第三周期;两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,以此来解答.
解答 解:①若在同周期,A为正价,A在B的前面,则A原子序数小于B,A应为第二周期IIA族或IVA族元素,如氟化铍或二氧化碳,故①正确;
②A不一定是B的前一周期元素,也可以是同周期,故②错误;
③两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,即A为C时属于非金属元素,故③错误;
④两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,故④正确;
故选A.
点评 本题考查位置、结构、性质,明确原子半径和化合价来确定元素的位置是解答本题的关键,题目难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
9.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 原子中均含22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 组成的金属钛单质互称同分异构体 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 在周期表中位置相同,都在第四周期 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
19. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为0.16 mol•L-1•min-1.
②该反应的逆反应为放(填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,且a>1 (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为放(填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,且a>1 (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
3.下列化学用语表达正确的是( )
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
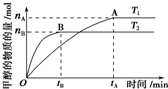 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题: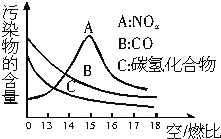 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.