��Ŀ����
����Ŀ���������ȣ�ClNO�������ںϳ�ϴ�Ӽ�����ý�������м��壬ijѧϰС����ʵ������Cl2��NO�Ʊ�ClNO���ⶨ�䴿�ȣ���������ʵ�飨�г�װ����ȥ����
�������ϣ��������ȣ�ClNO�����۵�Ϊ-64.5�桢�е�Ϊ-5.5�棬��̬�ʻ�ɫ��Һ̬ʱ�ʺ��ɫ����ˮ��Ӧ����һ���⻯������ֵ��ij������������һ�ֳʺ���ɫ��
��ش��������⣺
��.Cl2���Ʊ������շ��������ķ���������ʵ������ȡ��������Ҫ����֮һ��
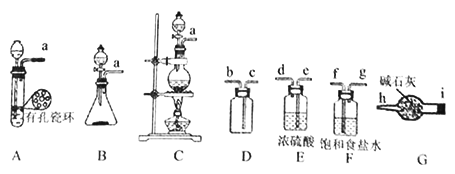
��1���÷�������ѡ����ͼ�е�________������ĸ��ţ�ΪCl2����װ�ã��÷�Ӧ�б������뱻��ԭ���ʵ����ʵ���֮��Ϊ_____________��
��2�����ռ�һƿ�����������ѡ����ͼ�е�װ�ã�������˳��Ϊ��a��____��i��h��������������Сд��ĸ��ţ���
���������ȣ�ClNO�����Ʊ���ʵ���ҿ�����ͼװ���Ʊ��������ȣ�ClNO����
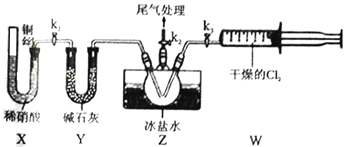
��3��ʵ����Ҳ����Bװ���Ʊ�NO����֮���X װ�õ��ŵ�Ϊ__________________________��
��4����װ��ʵ��װ�ú�Ӧ��____________��Ȼ������װ��ҩƷ����k2���ٴ�__________���k1����k3������ͨ��һ��ʱ�����壬��Ŀ����Ϊ���ž�������ƿ�еĿ�������ֹNO��ClNO ���ʡ�������,����������Z�з�Ӧ������Ϊ________________________________��
III���������ȣ�ClNO�����ȵIJⶨ���������������ȣ�ClNO����Ʒ13.10g����ˮ�����Ƴ�250mL��Һ��ȡ��25.00mL����K2CrO4��ҺΪָʾ������0.8mol��L-1AgNO3����Һ�ζ����յ㣬���ı���Һ�����Ϊ 22.50mL������֪��AgCrO4Ϊש��ɫ���壩
��5���������ȣ�ClNO����ˮ��Ӧ�Ļ�ѧ����ʽΪ_________________________��
��6���������ȣ�ClNO������������Ϊ______________________��
���𰸡� C 2:1 f��g��e��d��c��b �ų�װ���ڿ����ĸ��ţ������濪���ã������ͣ ���װ�õ������� k3 ���ֺ��ɫҺ�� 2ClNO+H2O=2H++2Cl-+NO��+NO2�� 90.0%
����������.(1)ʵ�����Ʊ������Ǽ��ȶ������̺�Ũ����Ļ���Ӧ��ѡ����ͼ�е�CΪCl2����װ�ã���Ӧ�ķ���ʽΪMnO2+4HCl![]() MnCl2+Cl2��+2H2O����Ӧ�ж������������������Ȼ����ǻ�ԭ�������뷴Ӧ���Ȼ���ֻ��һ�뱻���������������Ȼ����뱻��ԭ�Ķ������̵����ʵ���֮��Ϊ2:1���ʴ�Ϊ��C��2:1��
MnCl2+Cl2��+2H2O����Ӧ�ж������������������Ȼ����ǻ�ԭ�������뷴Ӧ���Ȼ���ֻ��һ�뱻���������������Ȼ����뱻��ԭ�Ķ������̵����ʵ���֮��Ϊ2:1���ʴ�Ϊ��C��2:1��
(2)�Ƶõ����������������Ȼ����ˮ��������Ҫ�ñ���ʳ��ˮ��ȥ�Ȼ��⣬����Ũ���������ռ�һƿ�����������ѡ����ͼ�е�װ�ã�������˳��Ϊ��a��f��g��e��d��c��b ��i��h���ʴ�Ϊ��f��g��e��d��c��b��
����(3)ʵ����Ҳ����Bװ���Ʊ�NO����֮���X װ�������ų�����װ���ڿ����ĸ��ţ������濪���ã������ͣ���ʴ�Ϊ�������ų�װ���ڿ����ĸ��ţ������濪���ã������ͣ��
(4)�漰����ķ�Ӧ����װ��ʵ��װ�ú�Ӧ�ȼ��װ�õ������ԣ�Ȼ������װ��ҩƷ����k2���ٴ�k3��ͨ��һ��ʱ�����壬��Ŀ����Ϊ���ž�������ƿ�еĿ�������ֹNO��ClNO ���ʡ�������������������Z�з�����Ӧ����ClNO����ȴ���ɺ��ɫҺ�壬�ʴ�Ϊ�����װ�õ������ԣ�k3�����ֺ��ɫҺ�壻
III��(5)��������(ClNO)��ˮ��Ӧ����һ���⻯������ֵ��ij������������һ�ֳʺ���ɫ��Ϊ�����������⻯��Ϊ�Ȼ��⣬���ݻ��ϼ۵ı仯����һ�ֵ���������Ϊһ������������������ˮ��Ӧ�Ļ�ѧ����ʽΪ2ClNO+H2O=2H++2Cl-+NO��+NO2�����ʴ�Ϊ��2ClNO+H2O=2H++2Cl-+NO��+NO2����
(6)�ζ��Ƿ����Ȼ����������������Ȼ�����ɫ�����ķ�Ӧ��������ש��ɫ���壬�Ұ����û�����Ա仯����ʾ�ﵽ�˵ζ��յ㣬n(Cl-)= n(Ag+)=0.0225L��0.8mol��L-1=0.018mol������������(ClNO)����������Ϊ ��100%=90.0%���ʴ�Ϊ��90.0%��
��100%=90.0%���ʴ�Ϊ��90.0%��





