题目内容
X、Y、Z、W为原子序数依次增大的四种短周期元素,其原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)Z的原子结构示意图为 .
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: .
(3)由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 .
(4)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标准状况下的体积为 L.
(1)Z的原子结构示意图为
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式:
(3)由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为
(4)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、W为原子序数依次增大的四种短周期元素,在周期表中X是原子半径最小的元素,则X为H元素;
Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素、Z为O元素、W为S元素,然后利用元素及其单质、化合物的性质来解答.
Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素、Z为O元素、W为S元素,然后利用元素及其单质、化合物的性质来解答.
解答:
解:X、Y、Z、W为原子序数依次增大的四种短周期元素,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素、Z为O元素、W为S元素,
(1)Z为O元素,原子结构示意图为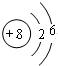 ,故答案为:
,故答案为: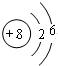 ;
;
(2)X为H、Y为N,化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲的化学式为N2H4,它的电子式为 ,故答案为:
,故答案为: ;
;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,故该酸是HNO3,稀硝酸与铜离子方程式为 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)氢化物的相对分子质量为43.0,其中氮原子的质量分数为97.7%,则氢原子的质量分数为2.3%,则n(N):n(H)=
:
=3:1,所以最简式为HN3,设化学式为(HN3)n,有(1+14×3)n=43,n=1,所以分子式为HN3;
2.15g该氢化物的物质的量为:n=
=0.05mol,根据反应2HN3═H2+3N2,产生气体的总物质的量为:0.05mol×2=0.1mol,标况下的体积为:0.1mol×22.4L/mol=2.24L,
故答案为:HN3;2.24.
(1)Z为O元素,原子结构示意图为
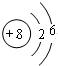 ,故答案为:
,故答案为: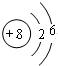 ;
;(2)X为H、Y为N,化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲的化学式为N2H4,它的电子式为
 ,故答案为:
,故答案为: ;
;(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,故该酸是HNO3,稀硝酸与铜离子方程式为 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)氢化物的相对分子质量为43.0,其中氮原子的质量分数为97.7%,则氢原子的质量分数为2.3%,则n(N):n(H)=
| 97.7% |
| 14 |
| 2.3 |
| 1 |
2.15g该氢化物的物质的量为:n=
| 2.15g |
| 43g/mol |
故答案为:HN3;2.24.
点评:本题考查位置、结构与性质关系的综合应用,题目难度中等,明确Y、Z、W的位置及原子序数的关系来推断元素是解答本题的关键,再利用单质、化合物的性质即可解答.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
为鉴别K2CO3和NaHCO3两种白色固体,下列4种方法中不可行的是( )
| A、分别取样配成溶液,滴加CaCl2溶液,观察有无白色沉淀 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的物质是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Fe.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Fe.
| A、全部 | B、①②③④ |
| C、①②③⑤ | D、②③④ |
下列有关物质性质和应用的说法正确的是( )
| A、碳酸钠受热易分解,可用于生产食品发酵粉 |
| B、次氯酸钠具有强氧化性,可用于配制消毒液 |
| C、二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸 |
| D、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
下列实验装置不能够达到目的是( )
A、 铁制品表面镀锌 |
B、 白色固体先变黄色,最后变成黑色 |
C、 验证碳酸酸性强于硅酸 |
D、 浸在冷水中的玻璃球颜色较浅 |
为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用( )
| A、烧碱溶液 | B、浓氨水 |
| C、镁粉 | D、铁粉 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、K+、H+、Cl-、HCO3- |
| B、Na+、Al3+、SO42-、OH- |
| C、Na+、NH4+、H+、Cl- |
| D、Fe3+、Ba2+、Cl-、SCN- |
