题目内容
NO、NO2等氮氧化物是大气污染物之一.NO2是火箭燃料中常用氧化剂.NO是人体中一种传递神经信息的“信使分子”.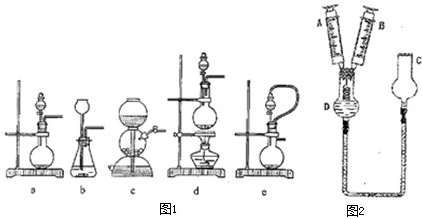
(1)实验室可用铜和不同浓度的硝酸制取NO和NO2.如图1中可选用的发生装置是
(2)实验室常用65%浓硝酸(密度为1.40g/cm3)的物质的量浓度是
(3)有学生设计如图2装置做铜与浓、稀硝酸反应实验.
a.实验时,先将一端绕成螺旋状的铜丝插入橡皮塞,再将两针头穿过橡皮塞,针头露出尖端.
b.从仪器C处注入浓硝酸直到左侧液面接近铜丝下端时停止加入.
c.注射器A中预先吸入6mL蒸馏水,注射器B的活塞挤到底,排尽空气,再将两支注射器插在针头上,如图2装配.
请回答下列问题:
①仪器C的名称是
②使浓硝酸与铜丝接触发生反应的操作方法是
③将注射器A中蒸馏水注入D中,再使酸液与铜丝接触反应,此时反应离子方程式是:
(4)氮氧化物(NOx)是目前大气污染治理的难题.
①选择性催化还原法是在催化剂条件下,用NH3使NOx转化为N2.写出反应化学方程式:
②炽热碳还原法是利用碳质固体还原NOx.主要基于下列反应:C+2NO→CO2+N2,2C+2NO2→2CO2+N2.清华大学有关研究表明,650℃~850℃时,NOx能够被木炭、无烟煤、焦炭等碳质固体还原,在所研究的NOx浓度下,还原率在99%左右.两者相比,分析炽热碳还原法的优缺点:优点是
分析:(1)金属铜和硝酸之间反应不需要加热,硝酸具有挥发性,要采用分液漏斗;
(2)根据质量分数和物质的量浓度之间的关系来计算,量取一定体积的液体可以采用量筒;
(3)①根据装置的特点来确定其名称;
②根据气压原理来回答;根据金属铜和硝酸之间反应生成硝酸铜,二氧化氮以及水来回答反应现象;
③金属铜和稀硝酸之间反应生成硝酸铜、一氧化氮以及水;
(4)①NH3能使NOx转化为N2和水,根据化学方程式的书写知识来回答;
②对比两个化学反应的特点得出结论.
(2)根据质量分数和物质的量浓度之间的关系来计算,量取一定体积的液体可以采用量筒;
(3)①根据装置的特点来确定其名称;
②根据气压原理来回答;根据金属铜和硝酸之间反应生成硝酸铜,二氧化氮以及水来回答反应现象;
③金属铜和稀硝酸之间反应生成硝酸铜、一氧化氮以及水;
(4)①NH3能使NOx转化为N2和水,根据化学方程式的书写知识来回答;
②对比两个化学反应的特点得出结论.
解答:解:(1)金属铜和硝酸之间反应不需要加热,并且硝酸具有挥发性,要采用分液漏斗,固体颗粒和液体之间的反应可以采用启普发生器来制取气体,
故答案为:ac;
(2)根据质量分数和物质的量浓度之间的关系c=
=
≈12.5mol/L,用浓硝酸配制体积比浓度为1:4的稀硝酸,需要用量取一定体积的浓硝酸,
故答案为:12.5mol/L;量筒;
(3)①根据装置的特点,c的名称是干燥管,
故答案为:干燥管;
②根据气压原理,用B注射器活塞往外拉,抽取D中的空气,减小压强,可以将金属铜丝和硝酸之间接触,金属铜和硝酸之间反应生成硝酸铜,二氧化氮以及水,现象是溶液变为蓝色,铜丝表面有气泡,产生红棕色气体,D中液面下降,C中液面上升,
故答案为:将B注射器活塞往外拉,抽取D中的空气;溶液变为蓝色,铜丝表面有气泡,产生红棕色气体,D中液面下降,C中液面上升;
③将注射器A中蒸馏水注入D中,硝酸变稀,金属铜和稀硝酸之间反应生成硝酸铜,一氧化氮以及水,反应的实质是:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)①NH3能使NOx转化为N2和水,化学方程式为4xNH3+6NOx═6xH2O+(2x+3)N2,
故答案为:4xNH3+6NOx═6xH2O+(2x+3)N2;
②对比两个化学反应C+2NO→CO2+N2,2C+2NO2→2CO2+N2,炽热碳还原法避免催化剂中毒,并且碳质固体价格比较便宜、NOx的还原率高,但是该方法煤耗量大且产生大量温室气体二氧化碳,
故答案为:避免催化剂中毒(碳质固体价格比较便宜;NOx的还原率高);煤耗量大且产生大量温室气体二氧化碳.
故答案为:ac;
(2)根据质量分数和物质的量浓度之间的关系c=
| 1000ρ×w% |
| M |
| 1000×1.40×65% |
| 73 |
故答案为:12.5mol/L;量筒;
(3)①根据装置的特点,c的名称是干燥管,
故答案为:干燥管;
②根据气压原理,用B注射器活塞往外拉,抽取D中的空气,减小压强,可以将金属铜丝和硝酸之间接触,金属铜和硝酸之间反应生成硝酸铜,二氧化氮以及水,现象是溶液变为蓝色,铜丝表面有气泡,产生红棕色气体,D中液面下降,C中液面上升,
故答案为:将B注射器活塞往外拉,抽取D中的空气;溶液变为蓝色,铜丝表面有气泡,产生红棕色气体,D中液面下降,C中液面上升;
③将注射器A中蒸馏水注入D中,硝酸变稀,金属铜和稀硝酸之间反应生成硝酸铜,一氧化氮以及水,反应的实质是:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(4)①NH3能使NOx转化为N2和水,化学方程式为4xNH3+6NOx═6xH2O+(2x+3)N2,
故答案为:4xNH3+6NOx═6xH2O+(2x+3)N2;
②对比两个化学反应C+2NO→CO2+N2,2C+2NO2→2CO2+N2,炽热碳还原法避免催化剂中毒,并且碳质固体价格比较便宜、NOx的还原率高,但是该方法煤耗量大且产生大量温室气体二氧化碳,
故答案为:避免催化剂中毒(碳质固体价格比较便宜;NOx的还原率高);煤耗量大且产生大量温室气体二氧化碳.
点评:本题考查学生氮的化合物的性质以及对环境的影响知识,属于综合知识的考查,难度大,综合性强.

练习册系列答案
相关题目
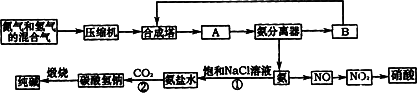
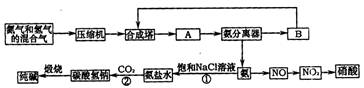
(08枣庄三诊)氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
|
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。