题目内容
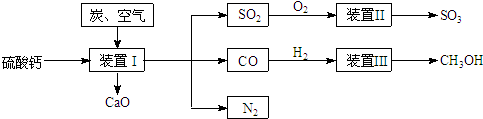
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图)。下列说法正确的是

- A.CO、SO2、SO3均是酸性氧化物
- B.除去与水反应,图5所示转化反应均为氧化还原反应
- C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
- D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
B
试题分析:A.CO与碱和水都不反应,不属于酸性氧化物,故A错误;
B.除去与水反应的两个反应,图示其余转化反应均有单质参加反应,元素的化合价一定发生变化,属于氧化还原反应,故B正确;
C.澄清石灰水的浓度较低,工业用Cl2和石灰乳反应制取漂白粉,故C错误;
D.CH3OH进而合成HCHO,原子利用率达不到100%,故D错误.
故选B。
考点:含硫物质的性质及综合应用 氯气的化学性质
点评:本题考查元素化合物知识,题目难度不大,本题注意从化合价的角度分析氧化还原反应,注意氧化物的分类和性质。
试题分析:A.CO与碱和水都不反应,不属于酸性氧化物,故A错误;
B.除去与水反应的两个反应,图示其余转化反应均有单质参加反应,元素的化合价一定发生变化,属于氧化还原反应,故B正确;
C.澄清石灰水的浓度较低,工业用Cl2和石灰乳反应制取漂白粉,故C错误;
D.CH3OH进而合成HCHO,原子利用率达不到100%,故D错误.
故选B。
考点:含硫物质的性质及综合应用 氯气的化学性质
点评:本题考查元素化合物知识,题目难度不大,本题注意从化合价的角度分析氧化还原反应,注意氧化物的分类和性质。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目