题目内容
在25℃时,用石墨电极电解1.0L 2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有3.2g Cu生成.
试回答下列问题:
(1)
(2)有
(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差
试回答下列问题:
(1)
阳
阳
极发生氧化反应,电极反应式为4OH--4e-═2H2O+O2↑
4OH--4e-═2H2O+O2↑
(2)有
0.1
0.1
mol电子发生转移,得到O2的体积(标准状况)是560
560
mL,溶液的pH是1
1
(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差
6.4
6.4
g,电解液的pH不变
不变
(填“变小”、“变大”或“不变”)分析:(1)电解池中阳极上氢氧根离子失电子发生氧化反应生成氧气;
(2)依据电极反应和电子守恒计算生成氧气物质的量得到氧气体积;,阳极电解过程中消耗的氢氧化钙离子和生成的氢离子物质的量相同计算溶液中的氢离子浓度计算得到pH;
(3)等质量的两块铜片代替石墨作电极,是镀铜装置,阳极溶解的铜和阴极析出的铜质量之和是电解相同时间后电解质量之差,电解过程中溶液中的铜离子浓度不变,溶液pH不变;
(2)依据电极反应和电子守恒计算生成氧气物质的量得到氧气体积;,阳极电解过程中消耗的氢氧化钙离子和生成的氢离子物质的量相同计算溶液中的氢离子浓度计算得到pH;
(3)等质量的两块铜片代替石墨作电极,是镀铜装置,阳极溶解的铜和阴极析出的铜质量之和是电解相同时间后电解质量之差,电解过程中溶液中的铜离子浓度不变,溶液pH不变;
解答:解:(1)用石墨电极电解1.0L 2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有3.2g Cu生成,说明析出同的电极为电解池的阴极,阳极上是氢氧根离子失电子发生氧化反应,电极反应为:4OH--4e-═2H2O+O2↑;
故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)石墨电极上有3.2g Cu生成物质的量为0.05mol,Cu2++2e-═Cu,转移电子物质的量为0.1mol;
阳极上是氢氧根离子失电子发生氧化反应,电极反应为:4OH--4e-═2H2O+O2↑;
4mol电子转移生成1mol氧气,0.1mol电子转移生成氧气物质的量为0.025mol,标准状况气体体积=0.025mol×22.4L/mol=0.56L=560mL;
反应过程中消耗氢氧根离子物质的量为0.1mol,溶液中生成氢离子物质的量0.1mol,c(H+)=
=0.1mol/L;
溶液pH=1;
故答案为:0.1;560;1;
(3)等质量的两块铜片代替石墨作电极,是镀铜装置,阳极溶解的铜和阴极析出的铜质量之和是电解相同时间后电解质量之差,即为3.2g+3.2g=6.4g,电解过程中溶液中的铜离子浓度不变,溶液pH不变;
故答案为:6.4;不变;
故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)石墨电极上有3.2g Cu生成物质的量为0.05mol,Cu2++2e-═Cu,转移电子物质的量为0.1mol;
阳极上是氢氧根离子失电子发生氧化反应,电极反应为:4OH--4e-═2H2O+O2↑;
4mol电子转移生成1mol氧气,0.1mol电子转移生成氧气物质的量为0.025mol,标准状况气体体积=0.025mol×22.4L/mol=0.56L=560mL;
反应过程中消耗氢氧根离子物质的量为0.1mol,溶液中生成氢离子物质的量0.1mol,c(H+)=
| 0.1mol |
| 1.0L |
溶液pH=1;
故答案为:0.1;560;1;
(3)等质量的两块铜片代替石墨作电极,是镀铜装置,阳极溶解的铜和阴极析出的铜质量之和是电解相同时间后电解质量之差,即为3.2g+3.2g=6.4g,电解过程中溶液中的铜离子浓度不变,溶液pH不变;
故答案为:6.4;不变;
点评:本题考查了电极原理的分析应用,电子守恒的计算应用,电极判断和计算是解题关键,题目难度中等,

练习册系列答案
相关题目
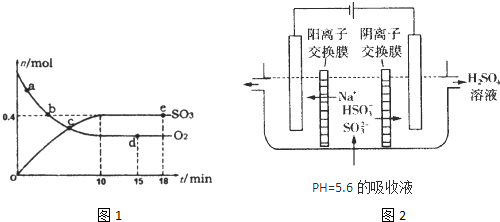
 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。