题目内容
为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
写出分解池中反应的化学方程式 。在合成塔中,当有4.4 kg CO2与足量H2
完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(2)以CO2为碳还可以制备乙醇,反应如下:
2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。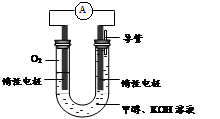
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。当电子转移 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)以甲醇为燃料还可制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质(可传导O2-)。该电池负极发生的电极反应是 ;放电时,O2-移向电池的 (填“正”或“负”)极。
(1)2KHCO3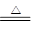 K2CO3+H2O+CO2↑(2分)
K2CO3+H2O+CO2↑(2分)
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.47kJ/mol(2分)
(2)2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol(2分)
(3)① O2 + 2H2O + 4e-= 4OH- (2分)
②2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O (2分) ; 1.2mol(2分)
(4)CH3OH-6e-+3O2-= CO2+2H2O(2分) 负(1分)
解析试题分析:(1)分解池中反应的化学方程式2KHCO3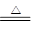 K2CO3+H2O+CO2↑。根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.47kJ/mol;(2)2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol,根据盖斯定律,对(1)中方程式乘以2然后用该方程式减去(1),可以得到CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol。(3)氧气在正极上被还原,在碱性条件下生成水,电池正极电极反应式为 O2 + 2H2O + 4e-= 4OH- ,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极。②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O 。参加反应的氧气的体积是6.72L(标准状况下),物质的量是0.3mol,转移电子物质的量为1.2mol。(4)甲醇在负极失去电子,该电池负极发生的电极反应是CH3OH-6e-+3O2-= CO2+2H2O;放电时,O2-移向电池的负极。
K2CO3+H2O+CO2↑。根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.47kJ/mol;(2)2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol,根据盖斯定律,对(1)中方程式乘以2然后用该方程式减去(1),可以得到CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol。(3)氧气在正极上被还原,在碱性条件下生成水,电池正极电极反应式为 O2 + 2H2O + 4e-= 4OH- ,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极。②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O 。参加反应的氧气的体积是6.72L(标准状况下),物质的量是0.3mol,转移电子物质的量为1.2mol。(4)甲醇在负极失去电子,该电池负极发生的电极反应是CH3OH-6e-+3O2-= CO2+2H2O;放电时,O2-移向电池的负极。
考点:本题以对CO2创新利用的研究为载体,考查热化学方程式、原电池,难度中等,旨在考查学生对知识的掌握及迁移运用能力。

甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示: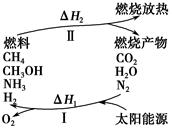
过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O===O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: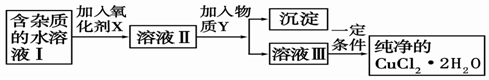
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么? ;
该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气: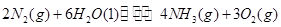
该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,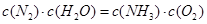 |
B.反应达到平衡后,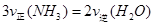 |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
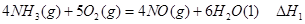 ①
①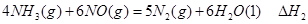 ②
②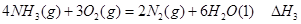 ③
③请写出上述三个反应中
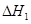 、
、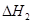 、
、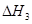 三者之间关系的表达式,
三者之间关系的表达式,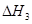 =_________。
=_________。(3)工业制硝酸的主要反应是:
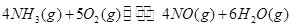
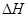 =
=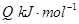
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 |  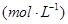 | 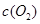 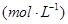 | 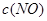 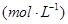 | 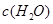 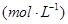 |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | a | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
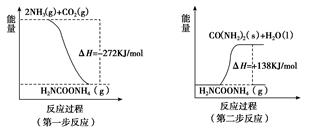
 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
 2N (g)
2N (g)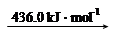 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
