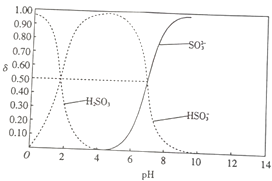
��Ŀ����
����Ŀ����֪��pAg=-lgc(AgCl)��Ksp(AgCl) =1��10-12����ͼ����10mLAgNO3��Һ������0.1mol��L-1��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ���������λmL)�仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ����[��ʾ��Ksp(AgCl)>Ksp(AgI)]
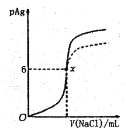
A.ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0.1mol��L-1
B.ͼ��x���ʾ��Һ��c(Ag+)=c(Cl-)
C.ͼ��x�������Ϊ��10��6)
D.��0.1mol��L-1 �� NaCl���� 0.1 mol��L-1 NaI����ͼ�����յ���Ϊ���߲���
���𰸡�B
��������
A. ͼ��ԭ��pAg��0����Ag+��Ũ��Ϊ��c(Ag+)��100mol/L =1mol/L����ԭAgNO3��Һ�����ʵ���Ũ��Ϊ1mol/L��A�����
B. x��c(Ag+)��106mol/L����Һ��c(Cl)=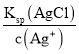 =106mol/L��������Һ��c(Ag+)��c(Cl)��B����ȷ��
=106mol/L��������Һ��c(Ag+)��c(Cl)��B����ȷ��
C. x��c(Ag+)��c(Cl)��106mol/L��һ����Ϊ��Һ������Ũ��С��105mol/L����������ȫ����AgNO3��NaClǡ�÷�Ӧ��n(NaCl)��n(AgNO3)��0.01L��1mol/L��0.01mol������V(NaCl)��100mL����x�������Ϊ(100��6)��C�����
D. ��AgCl��ȣ��⻯����Ksp(AgI)��С������0.1mol/L��NaCl����0.1mol/LNaI������Һ��c(Ag+)��С����pAg����ͼ����D�����
��ѡB��

 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�