题目内容
5.下表是元素周期表的一部分,请回答有关问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物的电子式
 ;
;(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
分析 根据元素周期表知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)最不活泼的元素是稀有气体元素;
(2)能形成两性氧化物的元素是铝,铝和强碱溶液能生成偏铝酸盐;
(3)活泼金属和活泼非金属元素之间易形成离子键,由阴阳离子构成的晶体是离子晶体;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(5)根据原子序数计算核电荷数之差.
解答 解:根据元素周期表知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)最不活泼的元素是稀有气体元素Ar,其原子结构示意图为: ,
,
故答案为: ;
;
(2)能形成两性氧化物的元素是铝,钾的最高价氧化物的水化物是氢氧化钾,氢氧化钾是强碱,铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)镁和氯元素之间形成离子键,则氯化镁的电子式为: ,
,
故答案为: ;
;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,①、②、⑥、⑦四种元素中非金属性最强的是Cl元素,所以Cl的最高价氧化物的水化物中酸性最强,其化学式为HClO4,
故答案为:HClO4;
(5)F的原子序数是9,其核电荷数是9,Br的原子序数是35,溴原子的核电荷数是35,所以二者核电荷数之差是26,
故答案为:26.
点评 本题考查了元素周期表的应用,明确元素在周期表中的位置是解本题关键,会运用元素周期律解答该题,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 10g甲烷中所含有的电子数目为10NA | |
| B. | 常温常压下,4g氦气所含有的质子数目为4NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | Fe-Cu和稀硫酸构成的原电池中,若生成2gH2,则转移的电子数目为2NA |
16.取质量为4.6g的纯净的金属钠平均分成两等份,做如下实验:
(1)第一块直接投入适量的水中,充分反应后得到了气体A和200mL溶液(甲);
(2)另一块在干燥空气中受热后转化成3.5g固体混合物(经检验固体中不含金属钠的单质、不考虑除氧气以外的其它气体反应物),再将所得固体全部投入适量的水中,充分反应后得到了气体B和200mL溶液(乙).求:
①同温同压下气体A和气体B的密度之比为1:16;
②溶液(甲)的物质的量浓度=1mol/L;
③试比较溶液的物质的量浓度:甲=乙(填“>”、“=”、“<”、“无法确定”);
④实验(2)所得固体中各成分的“分子式”及其物质的量:
(1)第一块直接投入适量的水中,充分反应后得到了气体A和200mL溶液(甲);
(2)另一块在干燥空气中受热后转化成3.5g固体混合物(经检验固体中不含金属钠的单质、不考虑除氧气以外的其它气体反应物),再将所得固体全部投入适量的水中,充分反应后得到了气体B和200mL溶液(乙).求:
①同温同压下气体A和气体B的密度之比为1:16;
②溶液(甲)的物质的量浓度=1mol/L;
③试比较溶液的物质的量浓度:甲=乙(填“>”、“=”、“<”、“无法确定”);
④实验(2)所得固体中各成分的“分子式”及其物质的量:
| 分子式 | Na2O | Na2O2 |
| 物质的量 | 0.025mol | 0.025mol |
13. 化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
 化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )| A. | 正反应吸热,m+n<ρ+q | B. | 正反应吸热,m+n>ρ+q | ||
| C. | 正反应放热,m+n<ρ+q | D. | 正反应放热:m+n>ρ+q |
10.硫酸的工业制备中,混合气体的组成是:SO2占7%、O2占11%,其余的是N2和CO2,现有100体积混合气体进入接触室反应后,导出的气体恢复到原温度和压强,变为97.2体积,则SO2的转化率约为( )
| A. | 60% | B. | 70% | C. | 80% | D. | 90% |
4.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氢氧化钠溶液共热产生使润湿的红色石蕊试纸变蓝的气体,一定有NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氯水,再加KSCN溶液显红色,一定有Fe3+ |
1.下列说法正确的是( )
| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 溶液、胶体与浊液的本质区别是其稳定性,胶体属于介稳体系 |
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.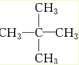 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.