题目内容
10.X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构.下列叙述正确的是( )| A. | X的核电荷数比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的最高化合价比Y的低 |
分析 X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构,X元素处于第四周期、Y处于第三周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多.
A.X元素处于第四周期、Y处于第三周期,X的核电荷数比Y的大;
B.X阳离子不一定为+1阳离子,Y阴离子不一定为-2价;
C.电子层结构相同,核电荷数越大离子半径越小;
D.主族元素最高正化合价等于最外层电子数.
解答 解:X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构,X元素处于第四周期、Y处于第三周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多.
A.X元素处于第四周期、Y处于第三周期,X的核电荷数比Y的大,则A错误;
B.X阳离子不一定为+1阳离子,Y阴离子不一定为-2价,如X的氧化物为CaO、Y的氢化物为HCl,故B错误;
C.两离子电子层结构相同,原子序数X>Y,故离子半径:X<Y,故C错误;
D.X原子最外层电子数小于Y原子的,故X的最高正价比Y的低,故D正确.
故选:D.
点评 本题考查结构与位置的关系、微粒半径等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
20.下列说法错误的是( )
| A. | 熔融态及溶于水后都不导电,熔沸点很低的物质一定属于分子晶体 | |
| B. | 甲醛和乙炔分子中均在σ键和π键,且每个分子中σ键数目相同 | |
| C. | 三氯化磷、二氧化碳、白磷分子中各原子均满足8电子的稳定结构 | |
| D. | HF、HCl、HBr、HI的热稳定性和酸性均依次减弱 |
1.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| D. | 1 mol Na被完全氧化生成Na2O2,失去NA个电子 |
15.下列关于苯(如图所示)的叙述正确的是( )


| A. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| B. | 反应①常温下能进行,其有机产物为 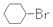 | |
| C. | 反应③为加成反应,产物是三硝基甲苯 | |
| D. | 反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
19.下列有关物质的性质、制取或应用等说法正确的是( )
| A. | 乙烯能发生加成反应,可用于合成塑料 | |
| B. | 在工业上,通过分馏石油可得到甲烷、乙烯、苯 | |
| C. | 实验室用苯和溴水混合,并加铁粉制取溴苯 | |
| D. | 可利用丁达尔效应来区别葡萄糖和蔗糖溶液 |
4.下列表示物质或微粒的化学用语正确的是( )
| A. | HF的电子式为 | |
| B. | 质子数为35,中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | Na2O2的电子式为: | |
| D. | 氯原子的结构示意图为: |



