题目内容
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
【答案】第二步 
【解析】
I.①已知总反应的快慢由慢的一步决定,②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小;
I.①已知总反应的快慢由慢的一步决定,第二步:N2O2(g)+O2(g)═2NO2(g) (慢),主要是由第二步决定反应速率,故答案为:第二步;
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则K=![]() =
= ;故答案为:
;故答案为: ;
;

【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如表所示。
变化如表所示。
序号 |
a克 | 温度
| 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
② | 方法 |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①前20min的平均反应速率![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①、②、③的化学平衡常数的关系:![]()
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
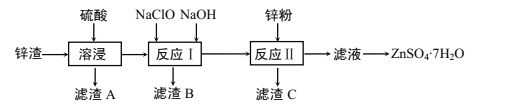
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O