题目内容
9.观察下列装置,回答下列问题: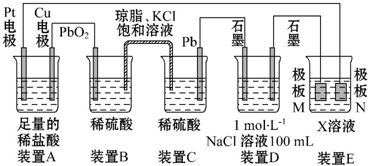
(1)装置B中PbO2上发生的电极反应方程式为PbO2+2e-+4H++SO42-═PbSO4+2H2O.
(2)若装置E的目的是在Cu材料上镀银,则X溶液为AgNO3,极板N的材料为Ag.
(3)当装置A中Cu电极质量改变3.2g时,装置D中产生的气体体积共为2.24L(标准状况下).
分析 (1)B和C装置形成原电池,铅作负极,二氧化铅作正极,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅;
(2)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同;
(3)根据转移电子守恒计算生成气体的体积.
解答 解:(1)B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+2e-+4H++SO42-═PbSO4+2H2O,
故答案为:PbO2+2e-+4H++SO42-═PbSO4+2H2O;
(2)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,若装置E的目的是验证金属的电化学防腐,则极板N的材料为惰性电极(或石墨等不溶性惰性材料),被保护的金属连接电源阴极,
故答案为:AgNO3;Ag;
(3)当装置A中Cu电极质量改变3.2g时,n(Cu)=0.05mol,则转移0.1mol电子,装置D中n(NaCl)=0.1mol,阳极发生2Cl-2e-=Cl2↑,则阳极生成0.05molCl2,
阴极发生2H++2e-=H2↑,生成0.05molH2,则总共生成0.1mol气体,体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子放电顺序是解本题关键,难点是电极反应式的书写,难度中等.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
19.目前我们所学的化学人教版必修一教材第二章第三节的内容是( )
| A. | 化学实验基本方法 | B. | 物质的分类 | ||
| C. | 离子反应 | D. | 氧化还原反应 |
17.下列说法正确的是( )
| A. | 氯气是一种具有刺激性气味的无色气体 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 铁分别与氯气、盐酸反应时得到相同的氯化物 |
14.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol OH-中含有10NA个电子 | |
| B. | 46g的NO2气体中含有NA个NO2分子 | |
| C. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA |
18.下列物质用途说法正确的是( )
| A. | 二氧化硅可用于制作半导体材料 | B. | 纯碱可用于制胃酸中和剂 | ||
| C. | 漂白粉可用于自来水的杀菌消毒 | D. | 甲醛可以用于食品防腐剂 |
19.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
请回答下列问题:
(1)定温度下,向0.1mol.L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- )•c(H+ )不变
(2)25℃时,0.10mol.L-1 Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH- ):10-3mol.L-1
(3)常温下,将20mL 0.10mol.L-1 CH3COOH溶液和20mL 0.10mol.L-1 HNO2 溶液分别与20mL 0.10mol.L-1 NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH )< v(HNO2)(填“>”、“<”或“:”),原因是据其电离平衡常数可知,HNO2的酸性比醋酸强,醋酸的酸性比碳酸强,相同物质的量浓度的醋酸和HNO2相比,HNO2溶液中氢离子浓度大,所以与碳酸氢钠溶液反应速率快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数(25℃) | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-4 |
(1)定温度下,向0.1mol.L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- )•c(H+ )不变
(2)25℃时,0.10mol.L-1 Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH- ):10-3mol.L-1
(3)常温下,将20mL 0.10mol.L-1 CH3COOH溶液和20mL 0.10mol.L-1 HNO2 溶液分别与20mL 0.10mol.L-1 NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH )< v(HNO2)(填“>”、“<”或“:”),原因是据其电离平衡常数可知,HNO2的酸性比醋酸强,醋酸的酸性比碳酸强,相同物质的量浓度的醋酸和HNO2相比,HNO2溶液中氢离子浓度大,所以与碳酸氢钠溶液反应速率快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.

 .
.