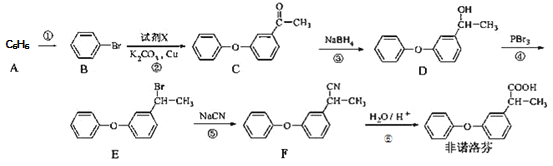
题目内容
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
【答案】A
【解析】
A项、2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,则热化学方程式为H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1,故A正确;
O2(g) ΔH=242 kJ·mol-1,故A正确;
B项、2mol氢气燃烧生成的水应该为气态,而不是液态,故B错误;
C项、反应为放热反应,此时焓变符号为负,则热化学方程式为H2(g)+![]() O2(g)= H2O(g) ΔH=—242 kJ·mol-1,故C错误;
O2(g)= H2O(g) ΔH=—242 kJ·mol-1,故C错误;
D项、反应为放热反应,此时焓变符号为负,则热化学方程式为2H2(g)+O2(g)= 2H2O(g) ΔH=—484 kJ·mol-1,故D错误;
故选A。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
![]() △H=+180 kJ·mol-1
△H=+180 kJ·mol-1
![]() △H=+68 kJ·mol-1
△H=+68 kJ·mol-1
则![]() △H=__________ kJ·mol-1
△H=__________ kJ·mol-1
(2)对于反应![]() 的反应历程如下:
的反应历程如下:
第一步:
第二步:![]()
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是______(填标号)
A 整个反应的速率由第一步反应速率决定
B 同一温度下,平衡时第一步反应的k1正/k1逆越大,反应正向程度越大
C 第二步反应速率低,因而转化率也低
D 第二步反应的活化能比第一步反应的活化能高
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:![]() △H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
△H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp=___________kPa-1(K
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
III:NO(*)=N(*)+O(*)
IV:CO(*)+O(*)=CO2+2Pt(s)
V:N(*)+N(*)=N2+2 Pt(s)
VI:NO(*)+N(*)=N2O+2 Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。

①330℃以下的低温区发生的主要反应的化学方程式是__________________________。
②反应V的活化能_____反应VI的活化能(填“<”、“>”或“=”),理由是_________________。
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

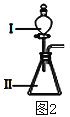
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。