题目内容
3.某硫酸厂每天排放的10 000m3(已换算成标准状况下体积)尾气中含0.2%(体积百分数)的SO2,为防止污染大气,在排放前设法进行综合利用.若用氢氧化钠溶液、石灰、及氧气处理后,假设硫元素不损失,则理论上可得到石膏(CaSO4•2H2O)的质量为153.57kg.分析 先求出尾气中的二氧化硫的体积和物质的量,根据S元素守恒求出石膏的物质的量和质量,由此分析解答.
解答 解:n(CaSO4)=n(SO2)=$\frac{10000×1{0}^{3}×0.2%L}{22.4L/mol}$,则m(CaSO4)=$\frac{10000×1{0}^{3}×0.2%L}{22.4L/mol}$×172g/nol=153700g=153.57Kg;
故答案为:153.57.
点评 本题考查学生元素守恒思想在解决元素以及化合物知识中的应用,侧重于考查学生的分析能力和计算能力,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.实验探究是体验知识的产生和形成过程的基本途径.下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管;CCl4在实验中所起的作用是萃取剂.
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
| 实验步骤 | 实验结论 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
18.下列各分散质微粒中,既能透过半透膜又能透过滤纸的是( )
| A. | 氯化铁溶液 | B. | 河水 | C. | 氢氧化铁胶体 | D. | 淀粉溶液 |
8.某环境网站的一幅图如下,有关说法正确的( )
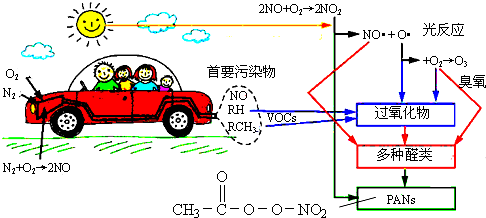

| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
15.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO与CO2 | B. | SiC与SiO2 | C. | NaCl与HCl | D. | Cl2与I2 |
9.有机化合物与人类生活水平的提高和人类社会的发展密不可分.下列对有机化合物的认识正确的是( )
| A. | 有机化合物都是共价化合物 | |
| B. | 有机化合物都含有碳、氢元素 | |
| C. | 有机化合物都具有同分异构现象 | |
| D. | 有机物种类多是由碳原子的成键特征决定的 |

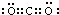 、
、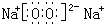 ;
;