题目内容
【题目】()下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为___。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK___NaClO,两溶液中:[c(Na+)-c(ClO-)]___[c(K+)-c(CH3COO-)]。
(3)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=___。
(4)碳酸钠溶液中滴加少量氯水的离子方程式为___。
(Ⅱ)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
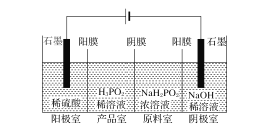
(1)写出阳极的电极反应式___。
(2)分析产品室可得到H3PO2的原因___。
【答案】c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 5 2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- 2H2O-4e-=O2↑+4H+ 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
【解析】
()(1)反应后溶质为KHC2O4,所得溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,又氢离子来自水的电离和草酸氢根离子的电离,则:c(H+)>c(C2O42-)>c(OH-);
(2)根据醋酸和次氯酸的电离平衡常数判断二者酸性强弱,酸性越强,对应的酸根离子的水解程度越弱,据此判断pH相同时醋酸钾和次氯酸钠的浓度大小;根据电荷守恒判断浓度关系;
(3)根据醋酸的电离平衡常数进行计算;
(4)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-,依据酸性强弱分析反应产物,然后写出反应的离子方程式;
(Ⅱ)(1)阳极发生氧化反应,水电离的OH-失去电子;
(2)阳极室产生H+,H+通过阳膜进入产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2。
()(1)H2C2O4与含等物质的量的KOH的溶液反应后溶质为KHC2O4,所得溶液呈酸性,则HC2O4-的电离程度大于其水解程度,再结合氢离子来自水的电离和草酸氢根离子的电离,则:c(H+)>c(C2O42-)>c(OH-),溶液中离子浓度由大到小顺序为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO;
由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:[c(Na+)-c(ClO-)]= [c(K+)-c(CH3COO-)],
故答案为:>;=;
(3)醋酸的电离平衡常数Ka=1.8×10-5= ,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×
,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5× =1×10-5mol/L,则该溶液的pH=5;
=1×10-5mol/L,则该溶液的pH=5;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-;
(Ⅱ)(1)阳极发生氧化反应,水电离的OH-失去电子,电极反应式为2H2O-4e-=O2↑+4H+;
(2)阳极室产生H+,H+通过阳膜进入产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2。

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案