题目内容
某温度下,2L密闭容器中加入4mol A和2mol B发生反应:3A(g)+2B(g)

4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )

4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )
A.反应的化学平衡常数表为K=
| ||
| B.增大压强,平衡右移,K平衡增大 | ||
| C.B的平衡转化率是40% | ||
| D.其他条件不变,向平衡体系中加入少量C,υ正、υ逆均增大 |
A.C为液体,不能列入平衡常数表达式中,k=
,故A错误;
B.平衡常数只与温度有关,温度不变,平衡常数不变,故B错误;
C.由反应的方程式可知,生成n(C)=1.6mol,则消耗B为0.8mol,B的平衡转化率是
×100%=40%,故C正确;
D.C为液体,增加C的量对反应速率无影响,故D错误.
故选C.
| c2D |
| C3(A)C2(B) |
B.平衡常数只与温度有关,温度不变,平衡常数不变,故B错误;
C.由反应的方程式可知,生成n(C)=1.6mol,则消耗B为0.8mol,B的平衡转化率是
| 0.8mol |
| 2mol |
D.C为液体,增加C的量对反应速率无影响,故D错误.
故选C.

练习册系列答案
相关题目
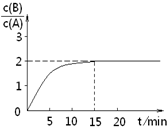 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |