题目内容
A、B、C三种强电解质,它们在水中电离出的离子如表所示:
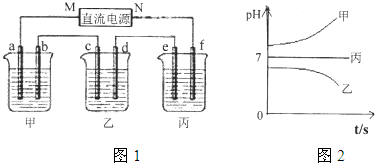 |
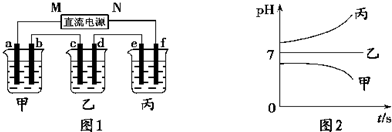
分析:测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
A、要使丙恢复到原来的状态,根据电解实质是电解水,需要加入水恢复浓度,不需要加入溶质;
B、e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
C、乙烧杯中为惰性电极电解硫酸铜溶液;
D、M为电源的负极,a电极为阳极,b电极为阴极,溶液中的氢氧根离子放电;
A、要使丙恢复到原来的状态,根据电解实质是电解水,需要加入水恢复浓度,不需要加入溶质;
B、e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
C、乙烧杯中为惰性电极电解硫酸铜溶液;
D、M为电源的负极,a电极为阳极,b电极为阴极,溶液中的氢氧根离子放电;
解答:解:测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
A、若经过一段时间后,实质电解水,要使丙恢复到电解前的状态,需向烧杯中加入水,故A错误;
B、e电极上氢离子放电生成氢气,n(Cu)=
=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L,故B正确;
C、乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故C正确;
D、碱溶液中OH-放电,电极反应为4OH--4e-=O2↑+2H2O;故D正确;
故选A.
A、若经过一段时间后,实质电解水,要使丙恢复到电解前的状态,需向烧杯中加入水,故A错误;
B、e电极上氢离子放电生成氢气,n(Cu)=
| 16g |
| 64g/mol |
C、乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O
| ||
D、碱溶液中OH-放电,电极反应为4OH--4e-=O2↑+2H2O;故D正确;
故选A.
点评:本题考查电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目